1.
4Al+3O2=>2Al2O3
4*27(4 моль алюминия*27 относительная атомная масса алюминия)=108
22.4*3(22.4 не помню,что такое,но число постоянное...какой то объем*3( мольк кислорода)=67.2
Теперь составляем пропорцию:
108-67.2
5.4-х
Решать пропорции,надеюсь,умеешь. Х=3.36л
2.
H2SO4+Zn=ZnSO4+H2
Относительная атомная масса сульфата цинка=161(65+16*4+32).
Находим пропорцией массовую долю цинка в сульфате:
161-100
65-Х
Х=40%(приблизительно)
Ну и теперь,считая,что цинк полностью растворился в кислоте находим пропорцией массу сульфата цинка:
13-40
Х-100
Х=32.5г
Ну а количество вещества=1 моль(видно из формулы реакции).
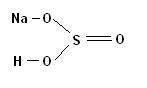
Ну например:
Это гидросульфит натрия.
Степень окисления серы в данном соединении равна +4. Потому что сера в данном соединении образует связи только с кислородом, а кислород более электроотрицателен, чем сера (т. е. переманивает её электроны к себе), и сера здесь проявляет валентность 4, соответственно степень окисления +4.
Схема:
Как видим, сера образует четыре ковалентные связи, и все с кислородом, а кислород более электроотрицательный, чем сера, и поэтому отнимает у неё электроны, соответственно заряд атома серы становится +4
M(NaOH) = 40 г/моль
n(NaOH) = 160 г/40 г/моль = 4 моль
M(H2SO4) = 98 г/моль
H2SO4 + 2NaOH = Na2SO4 + 2H2O
Из УХР следует, что n(H2SO4)=0,5n(NaOH) = 0,5*4 моль = 2 моль
m(H2SO4)=2 моль*98 г/моль = 196 г
m(p-pa H2SO4)=196 г/0,25 =784 г
ответ: 784 г
2)
Vm=22,4 л/моль
M(HCl) = 36,5 г/моль
m(HCl)= 150 r*0.15 = 22,5 r
n(HCl) = 22,5 г/36,5 г/моль = 0.616 моль
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O
Из УХР следует, что n(CO2)=0,5n(HCl) = 0.308 моль
V(CO2)= 0,308 моль*22,4 л/моль =6,9 л
ответ: 6,9 л