Внутримолекулярные окислительно-восстановительные реакции - реакции с изменением степеней окисления разных атомов входящих в состав одной молекулы.
К ним относится:
1) Степень окисления изменяет азот из N⁵⁺ в N⁴⁺ , а так же кислород из O²⁻ в O⁰. Исходя из определения выше , видим что и атомы кислорода и азота входят в состав одной молекулы, а значит это реакция внутримолекулярная ОВР.
2) Тут хим.вещества не входят в состав одной молекулы, тогда реакция межмолекулярная ОВР( реакция с изменением степеней окисления атомов в молекулах разных вещ-в).
3) Степень окисления изменяет водород из Н⁺ в Н⁰ , а так же кислород из O²⁻ в O⁰. Исходя из определения, видим что и атомы кислорода и водорода входят в состав одной молекулы, а значит это реакция внутримолекулярная ОВР.
4) Здесь степень окисления изменяет только кислород, переходя из О⁻ в О²⁻ и О⁰. Реакция диспропорционирования ( реакция с изменением степеней окисления одинаковых атомов в молекуле одного вещества).
5)Степень окисления изменяет марганец из Mn⁷⁺ в Mn⁴⁺ и Mn⁶⁺ , кислород из О⁸⁻ в О⁰. Исходя из определения выше , видим что и атомы кислорода и марганца входят в состав одной молекулы, а значит это реакция внутримолекулярная ОВР.
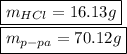
Объяснение:
Алгоритм:Найдем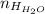 из количества атомов водорода в водеНайдем
из количества атомов водорода в водеНайдем 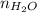 из количества вещества водорода в водеНайдем
из количества вещества водорода в водеНайдем 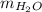 из количества вещества водыВычислим
из количества вещества водыВычислим 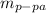 из массы воды и массовой доли HClУзнаем
из массы воды и массовой доли HClУзнаем 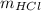 через массу раствора и массовую долю HClРешение:
через массу раствора и массовую долю HClРешение:Найдем количество вещества атомов водорода входящих в состав воды: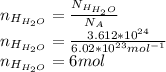
Молекул воды в два раза меньше чем атомов водорода, так как в каждой молекуле воды два атома водорода, следовательно и количество вещества воды в 2 раза меньше:
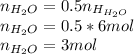
Найдем массу воды в растворе и рассчитаем массу всего раствора на основании массовой доли: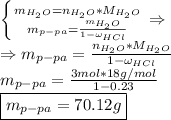
Отсюда же найдем массу безводного хлористого водорода: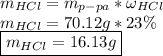
Если в растворе лишь два вещества, то их массовые доли в сумме дают единицу, или 100%: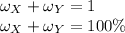
Количества вещества и другие показатели связывают формулы: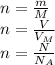
Если в молекуле вещества Y содержится m атомов вещества X, то их количества вещества связаны формулой:
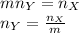
Анализируем условие задачи:
В реакцию вступают оба металла. Здесь водород из кислоты выделяется в обеих реакциях. Поэтому прямым расчётом здесь нельзя воспользоваться. В таких случаях удобно решать с очень простой системы уравнений, приняв за Х - число моль одного из металлов, а за Y - количество вещества второго.
1. Находим количество вещества водорода: n(H2)=V(H2)÷Vm=0.4моль.
2. Пусть количество алюминия Xмоль, а железа Yмоль. Тогда можно выразить через X и Y количество выделившегося водорода:
2AI + 6HCI=2AICI₃ + 3H₂ (1)
n(AI)=1моль n(H2)=3моль
n(AI)=Xмоль n(H₂)=1.5Xмоль
Fe + HCI=FeCI₂ +H₂
n(Fe)=Yмоль n(H₂)=Yмоль
3. Общее количество водорода: 0,4 моль, значит
1,5Х +Y=0,4моль (это первое уравнение в системе).
5. Для смеси металлов нужно выразить массы через количества веществ. M=nхm, отсюда m=M×n значит:
масса алюминия m(AI)=27X, масса железа m(Fe)=56Y
Масса всей смеси: 27X+56Y=11 (это второе уравнение в системе).
6. Итак, мы имеем систему из двух уравнений:
1,5Х +Y=0,4моль
27X+56Y=11
Решим такую систему методом вычитания, домножив первое уравнение на 18 и вычитая первое уравнение из второго:
27Х+18Y=7,2
(56-18)Y=11-7,2
Y=3,8÷38=0,1моль Fe
X=0,2мольAI (на основе реакции 1)
7. Находим массы металлов и их массовые доли в смеси:
масса железа m(Fe)=0,1мольх56г.моль=5,6г.
масса алюминия m(AI)=0,2моль х27г./моль=5,4г.
7. Находим массовые доли железа и алюминия в смеси:
ω(Fe)=5,6г.÷11г.= 0,509 ω%=ω(Fe)х100%=50,9%
ω(AI)=5,4г.÷11г.= 0,491 ω%=ω(AI)х100%=49,1%
8.ответ: в смеси массовая доля железа 0,509 или 50,9% и массовая доля алюминия 0,491 или 49,1%