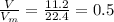 моль
моль =0.25*22.4=5.6 л
=0.25*22.4=5.6 л«Бекітемін»
Оқу ісі жөніндегі меңгеруші: Қайырқұл Ш.С
Сынып: 8 а,б сынып
Күні: 22.11.16
Сабақтың тақырыбы: №2 бақылау жұмысы
Сабақтың мақсаты
Білімділік: Оқушыларға қаныққан, қанықпаған көмірсутектер номенклатурасы, изомериясы, құрылысы, қасиеттері, алынуы туралы білімдерін тексеру;
Дамытушылық: Қаныққан, қанықпаған көмірсутектер гомолог, изомерлерінің құрылымдық формуласын және алынуы мен химиялық қасиеттерін сипаттайтын реакция теңдеулерін құру дағдыларын тексеру;
Тәрбиелік: сабақ уақытын бағалауға үйрету, еңбекқорлыққа және пәнге қызығушылығын арттыру.
Сабақ типі: Қорытындылау сабағы.
Сабақ өткізілу түрі: Жазбаша бақылау жұмысы
Құралдар мен реактивтер: Бақылау материалдары.
1.Ұйымдастыру кезеңі:
Амандасу.Оқушылардың сабаққа дайындығын тексеру. Оқушылардың көңілін сабаққа аудару. Сабақтың жалпы мақсатын ашу ,оны өткізу жоспарын көрсету.
Бақылау жұмысын орындау кезеңі:
1.Жазбаша бақылау жұмысын орындау
І нұсқа
Кальций элементіне периодтық кестедегі орны бойынша сипаттама:
Химиялық элементтің периодтық жүйедегі орны (периоды, тобы, рет саны), салыстырмалы атомдық массасы
ә) атом құрамы және құрылысы
б) энергетикалық деңгейде орналасуы: ( электрондық құрылысы, электрондық қабаты, ұяшықта орналасуы)
в) Элементтің қасиеті, валенттілігі
2. 45 г судағы моль санын есептеңдер
3. Формулалары мынадай: SO3; HClO; C6H12O6 заттардағы әр элементтердің массалық үлестерін есептеңдер
4. "Барий ботқасы" деп аталатын асқазанды рентген арқылы тексеруде жегізетін препараттың құрамында 58, 80% - барий; 13, 73% - күкірт; 27, 47% - оттегі болатыны белгілі болса, формуласы қандай?
ІІ нұсқа
Хлор элементіне периодтық кестедегі орны бойынша сипаттама:
Химиялық элементтің периодтық жүйедегі орны (периоды, тобы, рет саны), салыстырмалы атомдық массасы
ә) атом құрамы және құрылысы
б) энергетикалық деңгейде орналасуы: ( электрондық құрылысы, электрондық қабаты, ұяшықта орналасуы)
в) Элементтің қасиеті, валенттілігі
2. 5,6 л (қ.ж) SO2 (күкірт оксиді) моль саны қанша?
3. Формулалары мынадай: SO2; HClO2; C6H10O5 заттардағы әр элементтердің массалық үлестерін есептеңдер
4. Қарапайым теңіз жануары теңіз атының қаңқа сүйегі құрамында 47, 83% - стронций; 17, 39% - күкірт; 34, 78% - оттек болса, заттың молекулалық формуласы қандай?
5. Қосылыстағы көміртегі – 39,97 . Заттың формуласын табыңдар.
Объяснение:
ПР = [Ba²⁺] [SO₄²⁻] = 1.1*10⁻¹⁰
V=1 л
m(NaCl) = 5.85 г
M(NaCl) = 58.5 г/моль
n(NaCl) = m/M = 5.85 г/ 58,5 г/моль = 0,1 моль
C(NaCl) = n/V = 0,1 моль / 1 л = 0,1 моль/л = 0,1 М
В случае очень разбавленных растворов растворимость можно вычислять непосредственно из произведения растворимости:
ПР = [Ba²⁺] [SO₄²⁻] = 1.1*10⁻¹⁰
Так как в растворе нет избытка ионов бария или сульфат-ионов,
то [Ba²⁺] = [SO₄²⁻] и ПР = [Ba²⁺] ² = 1.1*10⁻¹⁰.
Отсюда
[Ba²⁺] = [SO₄²⁻] = √ПР = √1.1*10⁻¹⁰ = 1,05*10⁻⁵ M
Растворимость S(BaSO₄) = [Ba²⁺] = [SO₄²⁻] = 1,05*10⁻⁵ M
Если в растворе присутствуют посторонние ионы, тем более в избытке, то вместо концентраций ионов в формуле для ПР нужно использовать активности ионов.
Активность i-го иона a(i) равна концентрации c(i), умноженной на коэффициент активности γ(i):
a(i) = γ(i)c(i)
Коэффициенты активности вычисляются с ионной силы раствора μ.
Ионная сила раствора μ равна:
μ = 0.5*∑C(i)*z(i)², где С(i) - концентрация i-го иона, z(i) - его заряд. Суммирование идет по всем i-ым ионам.
В данном случае концентрацией ионов бария и сульфат-ионов можно пренебречь, поскольку она намного ниже концентрации ионов натрия и хлорид-ионов.
μ = 0.5*∑C(i)*z(i)² = 0.5*(0.1*1² + 0.1*(-1)²) = 0.5*(0.1+0.1) = 0.1
Коэффициенты активности для разбавленных растворов определяются через ионную силу по формуле:
lgγ(i) = -0.5*z(i)² √μ
В нашем случае z(i)² = 2² = 4 (коэффициенты активности мы определяем для двухзарядных ионов Ba²⁺ и SO₄²⁻),
lgγ(i) = -2*z(i)² √0,1 = -0,632
γ(i) = 10^(-0.632) = 0.233
Теперь вместо концентраций ионов в выражение для ПР подставляем активности:
ПР = γ(Ba²⁺)[Ba²⁺]γ(SO₄²⁻)[SO₄²⁻]
ПР = 0,233² [Ba²⁺][SO₄²⁻]
[Ba²⁺][SO₄²⁻] = ПР / 0,233²
[Ba²⁺][SO₄²⁻] = 1.1*10⁻¹⁰ / 0,233² = 2.03*10⁻⁹
[Ba²⁺]² = 2.03*10⁻⁹
[Ba²⁺] = √2.03*10⁻⁹
[Ba²⁺] = 4.5*10⁻⁵ M = [SO₄²⁻]
S(BaSO₄) = [Ba²⁺] = [SO₄²⁻] = 4.5*10⁻⁵ M
А первоначальная растворимость сульфата бария - 1,05*10⁻⁵ M
То есть после прибавления хлорида натрия растворимость сульфата бария выросла в 4.5*10⁻⁵ /1,05*10⁻⁵ раз, то есть в 4,3 раза.