Открытие новых химических элементов. Для развития теоретической химии этого периода исходным и основополагающим было создание Д. И. Менделеевым его периодической системы. Во-первых, пустые клетки таблицы Д. И. Менделеева (в 1871 г. было известно только 63 элемента) заполнились в результате открытий ученых различных стран, причем блестяще подтверждались предположения Менделеева о свойствах некоторых из этих неизвестных тогда элементов. До 1917 г. таблица пополнилась многими вновь открытыми элементами. Во-вторых, развитие теории строения атома по-новому объяснить физический смысл периодической системы элементов. Выяснилось, что и порядковый номер элемента, и его атомный вес являются характеристиками строения атома данного вещества. За это открытие в 1910 г. он был удостоен Нобелевской премии
Подробнее – на Otvet.Ws – https://otvet.ws/questions/7052708-chomu-periodichnii-zakon-spriyav-vidkrittyu-novih-himichnih.html
Объяснение:
1.неизвестный элемент массой 27 имеет 48,2 % протонов. Надо найти какой элемент. Чтобы найти нам нужно решить через пропорцию, т.е.
27(Э)---------100%
13 =х--------48,2%(протон)
=» протон= порядковый номер элементу= 13- алюминий Al
2. У нас имеется два изотопа Урана. Нам даны протоны(порядковый номер) и нейтрон,из него мы должны найти массу изотопов. Чтобы найти массу =протон+ нейтрон
m1(U)= 92+148=240 - масса тяжёлого уран
m2(U)= 92+135=227-масса лёгкого урана
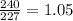
1,05 раз масса тяжёлого уран больше чем лекгий уран
2H2O2 =MnO2=> 2H2O + O2
n(O2) = 4 л/22,4 л/моль = 0,1786 моль
Из УХР следует, что n(H2O2)=2n(O2)
n(H2O2)=2*0,1786 моль = 0,3572 моль
М(Н2О2) = 34 г/моль
m(H2O2) = 0,3572 моль*34 г/моль = 12,14 г
ω(Н2О2) = 12,14 г/400 г = 0,03 или 3%
ответ: 3%