Reply by Kolokokosik
Задание 1:
Дано:
m(p-pa)=300г
w(KNO3)=0,5%
Найти:
m(H2O)=?
Решение
Найдём массу KNO3:
m(KNO3)=0,5 *300= 150
m(H2O)=300+150=450г
ответ: 150г и 450г
Задание 2:
РЕШЕНИЕ НА ВЛОЖЕНИИ
Задание 3:
Дано: Решение:
W(р-ра)=0,9% W(в-ва)=m(в-ва)/m(р-ра)*100%
m(р-ра)=0,5кг m(в-ва)= W(в-ва)* m(р-ра)/100%
m (NaCl)=? m(NaCl)= W(NaCl)* m(р-ра)/100%
m(H2O)=? m(NaCl)=0,9%*0,5кг/100%=0,0045кг
m(H2O)=m(р-ра)-m(сахара)=0,5кг-0,0045кг=0,4955кг
ответ: m(NaCl)= 0,0045кг; m(H2O)= 0,4955кг
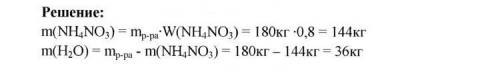
3CaO + 2H3PO4 = Ca3(PO4)2 + 3H20
n=3моль n=1моль
М=56г/моль М=310г/моль
m=168г m=310г
Mr(Ca3(PO4)2)=120+62+128=310
через пропорцию)
5,6гхг
168г310г
х=(5,6*310)/168=10,3г
через моль)
n(CaO):n(Ca3(PO4)2)=3:1(кол-во вещ-ва относятся как 3:1,т.к. в уравнении коэф. перед оксидом кальция-3,а перед фосфатом кальция-1)
n(CaO)=m/M=5,6г/56г/моль=0,1моль
n(Ca3(PO4)2)=n(CaO)/3=0,1моль/3=0,0333моль
m(Ca3(PO4)2)=n*M=310г*0,0333моль=10,3г
ответ: 10,3г
n(ню)-количество вещества
m(практ Ag)=10 g
m(AgNO3)=18 g
η-?
находим теоретическую массу металла
18 X
2AgNO3-->2Ag+2NO2+O2 M(AgNO3)=170 g/mol M(Ag)=108 g/mol
2*170 2*108
X=2*108*18 / 340
X=11.12 g
η=m(практ) / m(теор)*100% = 10 / 11.12*100%=89.9%
ответ 89.9%