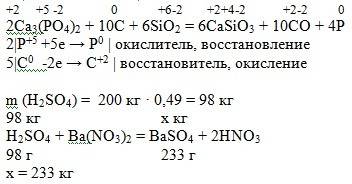
Объяснение:
На сплав алюминия и меди массой 100 г подействовали раствором соляной кислоты. При этом выделилось 117,6 л водорода (при н.у.). Уравнение реакции 2Al + 6HCl = 2AlCl3 + 3H2. Определите массовую долю алюминия в сплаве.
Медь с соляной кислотой не реагирует. Следовательно, весь водород 117,6 литра выделился в результате взаимодействия алюминия с соляной кислотой.
Каждые 2 моль алюминия образуют 3 моль водорода или 1 моль алюминия образует в результате реакции 1,5 моль водорода, которые в н.у займут объем 33,6 л.
Составим пропорцию 1 моль 33.6 л
х моль 117.6 л
Найдем величину х = 3,5 моль. Значит навеске находилось 3,5 моль алюминия. Молярная масса алюминия равна 27 г/моль, а 3,5 моль будет соответствовать масса алюминия 94,5 г
Рассчитаем массу меди 100 г - 94.5 = 5.5 г
Определим массовую долю алюминия в сплаве.
ω = 94,5 : 100 = 94,5 %
C3H8 + 5O2 -> 3CO2 + 4H2O
n=1 моль n=3 моль
Vm=22,4 л/моль Vm=22,4 л/моль
V = 22,4 л V = 67,2 л
21,2 л С3Н8 - Хл СО2
22,4 л С3Н8 - 67,2 л СО2
V(CO2) = 21,2 * 67,2 / 22,4 = 63,6 л