O
//
CH3COOH + C2H5OH = CH3 - C + H2O
\
O - C2H5
Определяем количество вещества этанола
n(C2H5OH) = m/M = 23г/ 46г/моль = 0,5 моль
По уравнению реакции n (эфира) = n(спирта) = 0,5 моль
Вычисляем массу образовавшегося эфира
m(эфира) = n x M = 0,5 моль х 88г/моль = 44 г
Уравнение реакции( один из вариантов):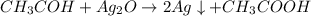
Чтобы расчитать выход продукта, нам нужно узнать сколько теоретически должно было выделиться продукта( "на бумаге").
Воспользуемся известной массой уксусного альдегида и найдём, сколько этого самого альдегида вступило в реакцию:
n( количество вещества) = m( масса) / M( молярная масса) - общая формула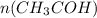 = 4,4 / 44= 0,1 моль
= 4,4 / 44= 0,1 моль
Из уравнения реакции видно, что коэффициент перед уксусным альдегидом равен коэффициенту перед уксусной кислотой, т.е. 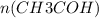 =
= 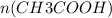 = 0,1 моль
= 0,1 моль
Теперь, пользуясь уже знакомой формулой n( количество вещества) = m( масса) / M( молярная масса), мы можем найти массу ( теоретическую) уксусной кислоты: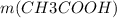 =
= 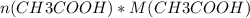 = 0,1 * 60 = 6 г.
= 0,1 * 60 = 6 г.
Выход продукта расчитываем по формуле:
w = m( практ) / m( теор) * 100% = 90%
ответ: выход продукта составил 90%.
m(H2O) = 510 г
m(соли) = 90 г
Найти:
ω(соли)-?
ω(соли)=m(соли)/m(p-pa)
m(p-pa) = m(H2O)+m(соли)
m(p-pa) = 510 г + 90 г = 600 г
ω(соли) = 90 г/600 г = 0,15 или 15%
ответ: 15%