1.
HNO3 + NH3 = NH4NO3
m(HNO3) = m(p-pa)*w(HNO3) = 600*0,42 = 252г
n(HNO3) = m(HNO3)/M(HNO3) = 252/63 = 4 моль
По уравнению n(NH4NO3) = n(HNO3) = 4 моль
m(теоретическая NH4NO3) = n(NH4NO3)*M(NH4NO3) = 4*80 = 320 г
выход = m(практическая)/m(теоретическую) = 300/320 = 0,9375 или ~ 94%.
2.
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
CuO + 2HNO3 = Cu(NO3)2 + H2O
n(NO2) = V(NO2)/Vm = 26,88/22,4 = 1,2 моль
По уравнению n(Cu) = n(NO2)/2 = 1,2/2 = 0,6 моль
m(Cu) = n(Cu)*M(Cu) = 0,6*64 = 38,4 г
m(CuO) = 75 - 38,4 = 36,6 г
W(CuO) = 36,6/75 = 0,488 или 48,8%.
3.
4P + 5O2 = 2P2O5
P2O5 + 3H2O = 2H3PO4
3NaOH + H3PO4 = Na3PO4 + 3H2O
2Na3PO4 + 3Ca(NO3)2 = Ca3(PO4)2 + 6NaNO3
3Ca + 2P = Ca3P2
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
2PH3 + 4O2 = P2O5 + 3H2O
P2O5 + 3K2O = 2K3PO4
2K3PO4 + 3Ca(NO3)2 = Ca3(PO4)2 + 6KNO3
Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2
Объяснение: Сила кислот отпределяется отдавать водород(диссоциировать в растворе на катион H⁺ и анион кислотного остатка), так вот.
Есть такая штука как электронная плотность(сами электроны) или как ее еще называют: "электронное одеяло". Более электроотрицательный элемент тянет на себя электронное одеяло от менее электроотрицательного элемента(это в парах Неметалл+Неметалл, т.к. в паре Металл+Неметалл все и так понятно). Что это значит? Например в молекуле HF есть H⁺ + F⁻, т.е. фтор забрал 1 электрон у водорода благодаря своей электроотрицательности. Почему? Потому что он может.
Итак, вернемся к кислоте. В пропионовой кислоте нам важно рассмотреть водород в составе OH(в COOH). По дефолту, с него тянет ЭП(электронная плотность) кислород(O-H). Когда в кислоте появляется Cl например, то ЭП с этого кислорода НЕМНОГО/ЧУТЬ/ЛЕГОНЬКО(никто не говорил что хлор сможет полностью сместить электронное одеяло на себя) отходит в сторону Cl, следовательно у водорода(в OH) ЭП забрали и он думает свалить, мол ловить здесь уже нечего, единственный электрон был, и его забрали. И получается так, что кислота легче диссоциирует на H⁺ и анион кислотного остатка. Что уж говорить про фтор. Он не просто НЕМНОГО сместит электрон от кислорода, а просто его заберет. Полностью. Без остатка. Ну или целых 2 фтора, как дано в 4 кислоте.
Что насчет 5 кислоты? Там ведь ни Cl, ни F. Никого нету. Для таких случаев есть правило: "Чем больше углеродов в кислоте - тем она слабее". Следовательно на первом месте муравьиная кислота(hcooh), потому что у нее только 1 углерод в составе карбоксила. в 5 кислоте целых 5 углеродов, поэтому она ни в какое сравнение с кислотами, перечисленными выше не идет.
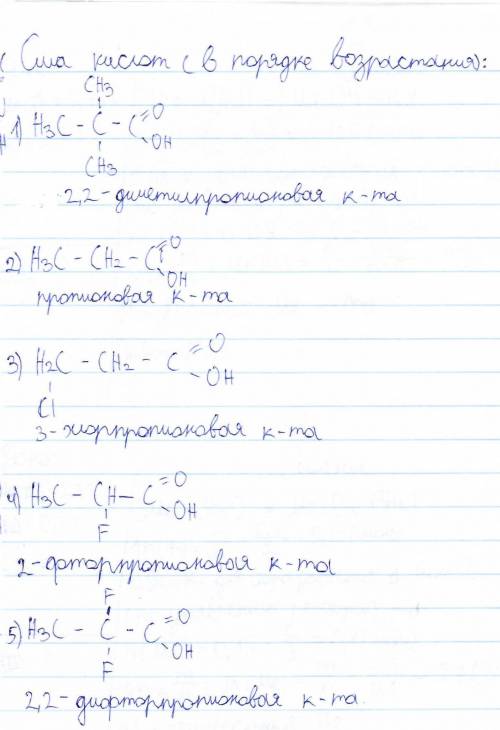
154.
С аммиаком в растворе получим аммонийную соль валериановой кислоты.
При нагревании получим амид валериановой кислоты.
При нагревании с водоотнимающим агентом P₂O₅ получим нитрил валериановой кислоты.
Далее восстанавливаем нитрил идет в две стадии.
Сначала до альдимина валериановой кислоты,далее до амина: пентиламина.
Далее с азотистой кислотой получим пентанол-1,
потом элиминирование с получением пентена-1.
Далее получаем 2-бромпентан.
С AgC≡N получим нитрил : нитрил 2-метилвалериановой кислоты.
Далее снова восстанавливаем до амина через альдимин и получаем 2-метилпентанамин-1.
126.
Начнем с того что то ,что вы написали карандашом неверно.
-Н₃С это ориентант l рода. Наблюдаем +l-эффекет метильной группы. Он отдаем электронную плотность в тороидальное облако π-ароматической системы и ориентирует электрофильное замещение орто и пара полодениях. Образовываться будут изомерные продукты,но нам нужно продолжать реакцию только с одним из них. Выбирать будем тот который ''главнее'',а имнно орто изомер. Почему он главнее? Да потому что в резонансной структуре компенсировать положительный заряд σ-комплекса проще именно в положении,которое ближе к ориентанту,а связано с тем,что l-эффект с расстоянием тухнет.
Получаем орто-сульфотолуол,далее
Орто-сульфонатнатрия толуола (наверное так),
далее щелочное плавление сульфоната с щелочью при t≈300-350°C.
Получаем орто-метилфенолят натрия.
Потом гидролиз кислотный и получили орто-ксилол.
А далее получаем эфир : орто-метилфениловый эфир уксусной кислоты.
Оба номера в двух прикрепленных скринах.