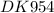Дано:
m(H₂O) = 40,5 гр
Найти:
m(NaOH) - ?
m(Na₃PO₄) - ?
1) Для начала мы запишем уравнение реакций то что известно по условию задачи, именно по такой уравнений реакций мы будем пользоваться:
3NaOH + H₃PO₄ → Na₃PO₄ + 3H₂O
2) Далее находим количества вещества у воды, потом у щелочи и образовавшейся соли по уравнению реакций:
M(H₂O) = 1×2 + 16 = 2 + 16 = 18 гр/моль
n(H₂O) = m(H₂O)/M(H₂O) = 40,5 гр / 18 гр/моль = 2,25 моль, следовательно:
n(H₂O) : n(NaOH) = 3 : 3 = 1 : 1 ⇒ n(NaOH) = n(H₂O) = 2,25 моль
n(H₂O) : n(Na₃PO₄) = 3 : 1 ⇒ n(Na₃PO₄) = 1/3 × n(H₂O) = 1/3 × 2,25 моль = 0,75 моль
3) Теперь находим массу у щелочи и образовавшейся соли:
M(NaOH) = 23 + 16 + 1 = 40 гр/моль
M(Na₃PO₄) = 23×3 + 31 + 16×4 = 69 + 31 + 64 = 164 гр/моль
m(NaOH) = n(NaOH) × M(NaOH) = 2,25 моль × 40 гр/моль = 90 гр
m(Na₃PO₄) = n(Na₃PO₄) × M(Na₃PO₄) = 0,75 моль × 164 гр/моль = 123 гр
ответ: m(NaOH) = 90 гр ; m(Na₃PO₄) = 123 гр
Решено от : 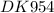
1. 2K⁺¹O⁻²H⁺¹ + Cu⁺²Cl₂⁻¹ → 2K⁺¹Cl⁻¹ + Cu⁺²(O⁻²H⁺¹)₂↓
Здесь ОВР не будет, так как степени окисления не изменились в этой реакций
2. Cu⁺²(O⁻²H⁺¹)₂ → Cu⁺²O⁻² + H₂⁺¹O⁻²
Здесь ОВР не будет, так как степени окисления не изменились в этой реакций
3. H₂⁺¹S⁺⁶O₄⁻² + Cu⁰ → S⁺⁴O₂⁻² + H₂⁺¹O⁻² + Cu⁺²S⁺⁶O₄⁻²
Cu⁰ - 2e⁻ → Cu⁺² | 2 | | 1 | - восстановитель - окисление
| | 2 | |
S⁺⁶ + 2e⁻ → S⁺⁴ | 2 | | 1 | - окислитель - восстановление
Следовательно получаем:
2H₂SO₄ + Cu → SO₂ + 2H₂O + CuSO₄
4. Pb⁺⁴O₂⁻² + Mn⁺²S⁺⁶O₄⁻² + H⁺¹N⁺⁵O₃⁻² → Pb⁺²S⁺⁶O₄⁻² +Pb⁺²(N⁺⁵O₃⁻²)₂ + H⁺¹Mn⁺⁷O₄⁻² + H₂⁺¹O⁻²
Pb⁺⁴ + 2e⁻ → Cu⁺² | 2 | | 5 | - окислитель - восстановление
| | 10 | |
Mn⁺² - 5e⁻ → Mn⁺⁷ | 5 | | 2 | - восстановитель - окисление
Следовательно получаем:
5PbO₂ + 2MnSO₄ + 6HNO₃ → 2PbSO₄↓ + 3Pb(NO₃)₂ + 2HMnO₄ + 2H₂O
Решено от :