1.Получение металлов из руд - задача металлургии.
Рассмотрите приведенные примеры и укажите тип металлургического процесса.
получения металла = Тип процесса
(1) Получение металлов с электролиза = (г) электрометаллургия
(2) Восстановление металлов из их соединений химически более активным металлом = (б) металлотермия
(3) Получение металлов из руд с реакций восстановления при высоких температурах = (а) пирометаллургия
(4) Получение металлов из растворов их солей = (в) гидрометаллургия
2. Металлы достаточно большой чистоты получают водородотермии. К этому относятся получение металла по реакции:
(3) MoO3 + 3H2 = Mo + 3H2O;
3. Рафинирование меди или никеля электролизом относится к получения металла:
(2). Электрометаллургией;
4. Наиболее важный минерал, содержащий около 7% лития,- это сподумен Li2O Al2O3 4SiO2 . Последней стадией производства лития является электролиз его хлорида. Превращение сподумена в LiCl протекает через ряд стадий. Представьте в виде схемы реакций каждую из стадий.
Стадия процесса
(1) Обработка раздробленного минерала серной кислотой …
Li2O Al2O3 4SiO2 + H2SО4 → Li2SO4 + Н[AlSi2О6].
(2) Выщелачивание сульфата лития водой и осаждение карбоната …
Li2SO4 + СаСО3 = Li2CO3 + Na2SO4
(3) Превращение карбоната в хлорид ...
Li2CO3 + 2HCl =2 LiCl + CO2 + H2O
(4) Электролитическое разложение расплава LiCl (в смеси с KCl) ...
2
LiCl =2 Li+Cl2
5. Какой металл нельзя получить в чистом виде из его оксида восстановлением водородом:
(3) кальций
6. Для получения металлов из их оксидов в промышленности в качестве восстановителей используют ……
СО УглеродВодородМеталлы7. Для получения металлов калия нельзя использовать метод, который заключается:
(3) в восстановлении KCI при нагревании в вакууме алюминием;
Задача коэффициентов это сделать так, чтобы и слева и справа реакции было равное кол-во атомов веществ.
Чтобы расставить коэффициенты нужно смотреть на кол-во атомов в молекуле, вот пример:
Н2 + О2 -> Н20 - Мы видим что изначально было Н2 (два водорода) - и в молекуле воды их столько же, то есть пока всё уравнено. Кислорода О2 (было два), а в молекуле воды он один. И именно поэтому мы делаем следующее:
Н2 + О2 -> 2Н2О, теперь каждое число в молекуле умножаем на этот коэффициент (в нашем случае это 2):
О(1) атом) × 2 -> 2, теперь кол-во кислорода слева и с права равны.
Но так как мы поставили коэффициент 2 и пере водородом, его тоже нужно умножить:
Н2 × 2 -> Н4 (а в начале было Н2, то есть теперь в самом первом Н2, нужно также поставить коэффициент 2, чтобы тоже было 4 водорода:
2Н2 + О2 -> 2Н2О - Вот и всё, на самом деле главное практика, всё у Вас получится.
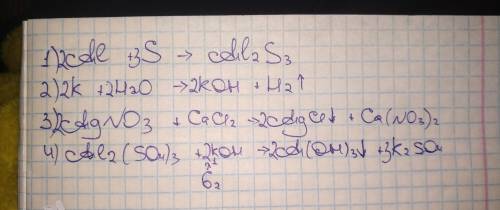
2I(-1) -2е = I2(0), окисление, восстановитель
Fe(+3) +1e = Fe(+2), восстановление, окислитель
Наименьшее общее кратное 2, следовательно,
2I(-1) + 2Fe(+3) = I2(0) + 2Fe(+2)
2KI + 2FeCl3 = I2 + 2FeCl2 + 2KCl