Короче, тут надо знать какой концентрации кислота, ибо реакции при разной концентрации протекают по-разному!
Ладно! Будем думать, что в первом случае у нас фосфорная кислота- безводная, т.е концентрация 100%, тогда составим уравнения реакции:
1) (При не очень высокой температуре)
2)Пишем в ионной форме: Сразу скажу, поскольку все соли растворимые, и кислоты, то в сокращённой ионной форме получится:
3)Для реакции с магнием, возьмём разбавленную фосфорную кислоту. Если надо реакции с концентрированной, то вот тебе правило: Чем выше концентрация фосфорной кислоты, тем больше атомов металла будут замещаться атомами водорода, т.е будут получаться кислые соли, например:
в данном случаем, магний заместил атомы водорода. В ходе данной реакции выпал осадок и выделился газ, запишем это в полной и сокращённой ионных формах:
Приливаем BaCl2 к аликвотам раствором из всех трех пробиркам. С KCl реакция не пойдет, а вот в остальных двух пробирках выпадет осадок - BaHPO4 и BaSO4 соответственно.
Снова берем аликвоты пробирок, на этот раз только из двух, добавляем к ним AgNO3. В одной пробирке осадок будет очень неярко выраженным ( Ag2SO4 малорастворим), а вот в другой будет четко виден - Ag2HPO4.
Тогда в пробирке, с которой не пошла первая реакция - KCl, там где осадок был неярко выраженным - (NH4)2SO4, а там, где он был хорошо виден - CaHPO4.
Короче, тут надо знать какой концентрации кислота, ибо реакции при разной концентрации протекают по-разному!
Ладно! Будем думать, что в первом случае у нас фосфорная кислота- безводная, т.е концентрация 100%, тогда составим уравнения реакции:
1)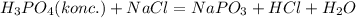 (При не очень высокой температуре)
(При не очень высокой температуре)
2)Пишем в ионной форме: Сразу скажу, поскольку все соли растворимые, и кислоты, то в сокращённой ионной форме получится:
3)Для реакции с магнием, возьмём разбавленную фосфорную кислоту. Если надо реакции с концентрированной, то вот тебе правило: Чем выше концентрация фосфорной кислоты, тем больше атомов металла будут замещаться атомами водорода, т.е будут получаться кислые соли, например: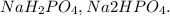
в данном случаем, магний заместил атомы водорода. В ходе данной реакции выпал осадок и выделился газ, запишем это в полной и сокращённой ионных формах:
Т.е магний восстановил водород.