ZnO + 2HCl = ZnCl2 + H2O
Реакция с щелочью:
ZnO + 2NaOH + H2O = Na2[Zn(OH)4]
2. Химическая активность убывает, потому что количество электронов на внешнем электронном уровне возрастает.
3.Дано: m(Cr2O3)=200кг ; w(примеси)=5%; wвыхода(Cr)=90%.
Найти: m(Cr)-?
Решение: 1) Запишем реакцию: Cr2O3 + 2Al = Al2O3 + 2Cr
2)m(примесей)=200*0.05=10г
Найдем массу хрома без примесей:
m(Cr2O3) = 200-10=190г
CH4 (г.) +2O2 (г.) =CO2 (г.) +2H2O (г.) +890 кДж
Так, нам известно, что в ходе данной реакции выделилось 890 кДж теплоты, т.е Q1= 890 кДж; Значит, реакция экзотермическая.
По уравнению реакции, найдём при каком объёме метана выделилось Q1:
Ведём рассчёты только по уравнению! Видно, что вступило в реакцию 1 моль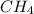 ,т.е n(
,т.е n(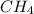 ) = 1 моль, значит объём прореагировавшего метана равен: V(
) = 1 моль, значит объём прореагировавшего метана равен: V(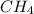 ) = Vm * n(
) = Vm * n(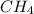 ) = 22,4 л/моль * 1 моль = 22,4 л.
) = 22,4 л/моль * 1 моль = 22,4 л.
Теперь нам известно, что при сгорании 22,4 л метана образовалось 890 кДж. А при сгорании 112 л метана количество теплоты неизвестно! Составим пропорцию:
22,4 л - 890кДЖ
112 л - x кДЖ => xкДж= 112 л * 890кДЖ/22,4 л= 4450 => при сгорании 112 л метана образовалось 4450 кДж теплоты, т.е Q2= 4450 кДж.
И проверь все рассчёты, а вдруг Не забудь тыкнуть на