1.чему равна степень диссоциации электролита, если при растворении его в воде из каждых 100 молекул на ионы распалось: а) 5 молекул, б) 80 молекул? 2.в перечне веществ подчеркните слабые электролиты: h2so4; h2s; cacl2; ca(oh)2; fe(oh)2; al2(so4)3; mg3(po4)2; h2so3; кон, kno3; hcl; baso4; zn(oh)2; cus; na2co3.
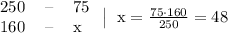 грам
грам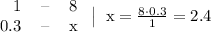 грами
грами
(5/100)*100%=5%
(80/100)*100%=80%
2)Чтобы ты понял(-а), сильными электролитами считаются те, у которых связь между атомами слаба, которые больше разлагаются на ионы. Это кислоты (не все), соли, щелочи. Серная кислота сильная, а дальше сам(-а).