1. определите валентность элементов по формулам соединений: al2o3, сн4, n2o3, so3. 2. составить формулы соединений, в состав которых входят следующие элементы: а)водород и кальций(ii); б)железо (ii) и кислород; в)натрий(i) и азот(iii). 3. расставьте коэффициенты в уравнениях реакций, укажите типы реакций: li + o2 →li2o аl + нсl → аlсl3 + н2↑ для последнего уравнения рассчитать массу и количество вещества алюминия, израсходованные на получение 1 г водорода. 4. допишите уравнения реакций: mg(ii) + o2 → ? ва(ii) + s(ii) → ? 5. вычислить массу 7 моль дисульфида железа fеs2. чему равна массовая доля железа в дисульфиде железа?
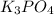 и
и 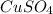
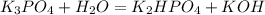 - это молекулярное уравнение гидролиза соли по первой ступени; запишем теперь ионные уравнения:
- это молекулярное уравнение гидролиза соли по первой ступени; запишем теперь ионные уравнения: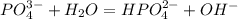
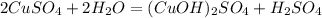 (первая ступень)
(первая ступень)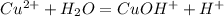 (ионное уравнение), pH<7
(ионное уравнение), pH<7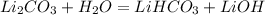
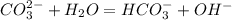 , pH>7
, pH>7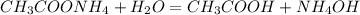
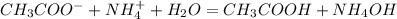 , pH =7
, pH =7 , pH = 7
, pH = 7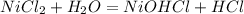
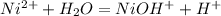 , pH<7
, pH<7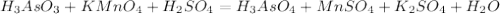 ; распишем процессы окисления-восстановления:
; распишем процессы окисления-восстановления: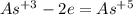
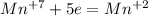
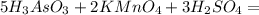
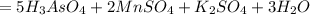
Al2(|||)O3(||), С(|V)Н4(|), N2(|||)O3(||), S(V|)O3(||).
2.
а)водород и кальций(II); CaH2
б)железо (II) и кислород; FeO
в)натрий(I) и азот(III).Na3N
3. 4Li + O2 →2Li2O Реакция соединения
2Аl + 6НСl → 2АlСl3 + 3Н2↑ Реакция замещения
m(Al) = x; x = 52*1/6; x = 8.6 гр
n(Al) = m/M; 8.6/52 = 0.16 моль
4. Допишите уравнения реакций:
2Mg(II) + O2 → 2MgO
Ва(II) + S(II) → BaS
5. Вычислить массу 7 моль дисульфида железа FеS2. Чему равна массовая доля железа в дисульфиде железа?
m(FeS2) = n*M; m = 7 * 112 = 784 гр
W(Fe) = Ar(Fe)/Mr(FeS2) * 100%= 56/112*100% = 50 %