1. ca(oh)2 + 2nacl = CaCl2 2naoh
caso4 + 2hcl = cacl2 + h2so4
2. ca(oh)2 + hcl = cacl2 + h2o
3. находятся в 1 группе главной подгруппе(А), очень мягкие при комнатных температура, можно резать ножом. легкоплавкие, легкие. на последней орбитале имеют 1 электон.
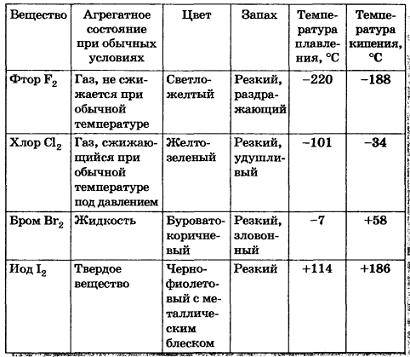
4. щелочные металлы - твердные, галогены - газы(летучие). В твердом состоянии Р2, Сl2, Вг2,I2 имеют молекулярные кристаллические решетки, что и подтверждается их физическими свойствами (см. вложение)
5. Практическое значение имеют главным образом Na2 SO4 (в технике часто называемый просто сульфат) и K2 SO4 , особенно первый из них. Важнейшим их потребителем является стекольная промышленность. Кристаллогидрат Na2 SO4 ·10H2 O («мирабилит», или «глауберова соль») применяется в медицине как слабительное.
___
Фтор применяют для синтеза фтороуглеродов - фреонов (они используются как хладоагенты и для распыления аэрозолей - красок, лаков и т.д.), химически стойких материалов - тефлонов (-CF2-CF2-). Фториды металлов находят применение при изготовлении оптических элементов - призм, фильтров, волоконных проводов для оптоэлектронной связи.
Хлор используют при получении хлоридов металлов и неметаллов (например, AlCl3 , FeCl3,, PCl3 и т.д.), соляной кислоты, различных хлорорганических соединений: растворителей - тетрахлорметана CCl4, трихлорэтилена CHCl-CCl2, антисептиков и инсектицидов - ДДТ (дихлородифенилтрихлорэтана), лекарственных препаратов (хлоральгидрата - снотворного, гексахлорафена - бактерицидного вещества), отбеливателей.
Бром и иод применяют в фотографии (галогениды серебра, свинца), при получении присадок к бензину (С2H4Br2), ингибиторов воспламенения, в галогенных лампах.
1) Если концентрацию раствора выразить в долях единицы, то массу растворенного вещества в граммах находят по формуле:
m(в-во) = ω * m(p-p)
где: m(p-p) - масса раствора в граммах,
ω - массовая доля растворенного вещества, выраженная в долях единицы.
35% - это 0,35 в долях единицы.
2) Обозначим концентрацию нового раствора через Х.
При добавлении вещества масса растворенного вещества увеличилась на 100 г, но и масса раствора тоже увеличилась на 100 г.
На основании всего выше изложенного составляем уравнение:
0,35*140 + 100 = Х*(140 + 100)
49 + 100 = 240Х
240Х = 149
Х = 0,6208 ( или 62,08% )
Второй
1) Находим массу растворенного вещества в исходном растворе:
35*140/100 = 49 г
2) После того. как добавили еще 100 г сухой соли, масса растворенного вещества стала:
49 + 100 = 149 г
3) Масса раствора была 140 г, добавили 100 г соли, масса раствора стала 140 + 100 = 240 г
4) Тогда концентрация нового раствора равна:
 %
%
И так порядок будет такой J(Йод),Br(бром),Cl(хлор),F(фтор).
Значит наиболее ярко выраженные неметаллические свойства у фтора.
Элемент Фтор. Подрядковый номер 9, протонов 9, элеткронов 9, нейтронов 10, атомная масса 19 грамм. 7 группа, главная подгруппа, 2 период.