ответ:
объяснение:
дано:
m (nh4cl) = 75 г;
найти:
m (nh3) - ?
решение:
1) составляем уравнение реакции согласно условию :
nh3 + hcl = nh4cl;
2) находим количество хлорида аммония, содержащееся в 75 граммах соли:
n (nh4cl) = m : m = 75 г : 53,5 г/моль = 1,4 моль;
3) составляем логическое равенство:
если 1 моль nh3 дает 1 моль nh4cl,
то x моль nh3 даст 1,4 моль nh4cl,
тогда х = 1,4 моль.
4) находим массу аммиака, затраченную на протекание реакции:
m (nh3) = n * m = 1,4 моль * 17 г/моль = 23,8 г;
ответ: m (nh3) = 23,8 г.

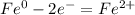
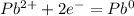
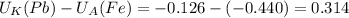 В (Вольт)
В (Вольт)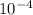 то ЭДС необходимо рассчитать с формулы Нернста:
то ЭДС необходимо рассчитать с формулы Нернста:![((U_{K})^o+ \frac{0,059}{n}lg[Me^{n+}]_k)-( (U_{A})^o)+ \frac{0,059}{n}lg[Me^{n+}]_a )](/tpl/images/0408/4708/bd0bf.png)
 В (Вольт)
В (Вольт)
200 *40 :100 = 80 г
2) 80:10 = 8 ложек соли нужно положить в стакан
3) Найдем сколько нужно добавить воды:
200 -80 = 120 г воды
Итак, в стакан нужно положить 8 ложек соли и залить 120 грамми воды