16.9%
Объяснение:
Пишем первую реакцию
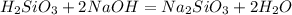
Считаем массу гидроксида натрия
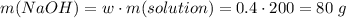
Считаем количество вещества кремниевой кислоты
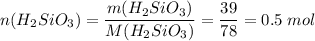
Для реакции нужно вдвое больше гидроксида натрия, т.е. 1 моль или 40 г, а есть 80 г, поэтому расчеты ведем по кремниевой кислоте
Силиката натрия образуется столько же, сколько и было кремниевой кислоты, т.е. 0.5 моль
Пишем вторую реакцию
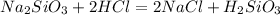
Для полного взаимодействия с 0.5 моль силиката натрия нужно 1 моль кислоты, т.е. 36.5 г. Считаем сколько есть
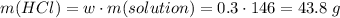
Видим, что соляной кислоты в избытке, поэтому расчеты ведем по силикату натрию
Во время реакции образуется 1 моль хлорида натрия, т.е. 58.5 г и 0.5 моль кремниевой кислоты, т.е. 39 г, которая выпадает в осадок и в массе раствора не считается
Считаем всю массу раствора
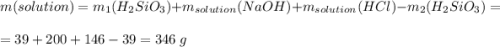
Считаем массовую долю хлорида натрия

б) NH2CH2COOH+НСl=NH3CH2COOHCl
d)C6H5NН2 + 3Br2 => NН2C6H2Br3↓ + 3HBr