Объяснение:
Вещество, полученное на катоде при электролизе расплава хлорида меди (II),
реагирует с серой. Полученный продукт обработали разбавленной азотной кислотой.
Полученное простое вещество желтого цвета сожгли в избытке кислорода с образованием
бесцветного газа с резким удушливым запахом.
Очевидно требуется написать все уравнения приведенных реакций.
электролиз
СuCl2 > Cu + Cl2↑
медь
Сu + S = Cu2S
cульфид меди (I)
3Cu2S + 16HNO3 (разб) = 6Cu(NO3)2 + 3S↓ + 4NO + 8H2O
сера
S + O2 = SO2↑
диоксид серы
9,41 л
Объяснение:
Дано:
m(Na₂SO₄) = 60 г
Найти:
V(SO₃) - ?
Реакция: Na₂O + SO₃ → Na₂SO₄
1) Находим количество вещества сульфата натрия: 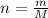 , где n - количество вещества (моль), m - масса (г), М - молярная масса (г/моль)
, где n - количество вещества (моль), m - масса (г), М - молярная масса (г/моль)
Молярная масса эквивалентна молекулярной, поэтому считается как сумма атомных масс элементов, входящих в соединение. Атомные массы даны в таблице Менделеева:
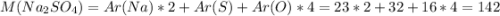 г/моль
г/моль
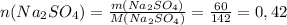 моль
моль
2) В любой реакции главное равенство количеств веществ. По реакции видно, что 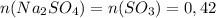 моль (смотри по коэффициентам: у всех они равны 1)
моль (смотри по коэффициентам: у всех они равны 1)
3) Находим объем газа по формуле: 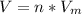 , где V - объем (л), n - количество вещества (моль), Vm - молярный объем (л/моль)
, где V - объем (л), n - количество вещества (моль), Vm - молярный объем (л/моль)
Молярный объем при н.у. для всех газов одинаков: 22,4 л/моль
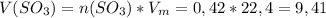 л
л
ответ: 9,41 л SO₃
В первом растворе содержится соли:
7г в 100г
x1в 200г
x1=14 г
Во втором:
20г в 100г
x2в 700г
x2=140г
Общая масса соли в двух растворах 14+140=154 г
Общая масса двух растворов 200+700=900 г
Тогда массовая доля соли в новом растворе:
w соли =m соли/ m раствора *100%=154/900 *100%=
17.11%
ответ: 17.11%