1. Электроны заряжены отрицательно. Ядро заряжено положительно.
2. Заряд ядра атома зависит от количества протонов в ядре. Его можно узнать из ПСХЭ. Число электронов равно числу протонов.
3. Электронным облаком называется совокупность различных положений быстро движущегося электрона. Энергетическим уровнем называется совокупность орбиталей, которые имеют одинаковое значение главного квантового числа. Квантовой ячейкой выражается атомная орбиталь - это часть атомного пространства, в которой вероятность нахождения данного электрона максимальна. Спин, или спиновое квантовое число - это характеристика электрона, которая выражает вращение электрона вокруг собственной оси.
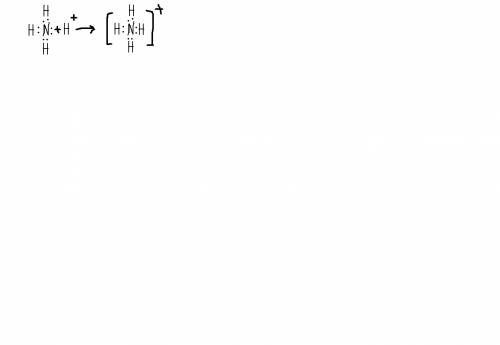
N2O5- оксид азота (5), кислотный оксид, при взаимодействии с водой образует кислоту N2O5+H2O=2HNO3
Li2O- оксид лития (1), основной оксид, при взаимодействии с водой образует гидроксид Li2O+H2O=2LiOH
B2O3- оксид бора (3), относится к амфотерным оксидам, но в данном случае при взаимодействии с водой образует кислоту и является кислотным оксидом В2О3+3Н2О=2Н3ВО3