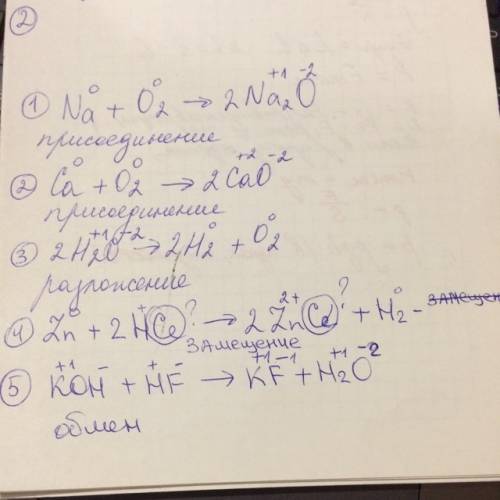
С гидроксидом лития:
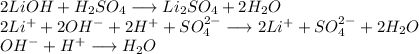
Признак протекания реакции: отсутствуют.
C медью (если кислота концентрированная):
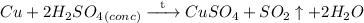
Это окислительно-восстановительная реакция, не ионного обмена, поэтому ионного уравнения нет.
Признак протекания реакции: раствор приобретает голубой оттенок (за счет образования сульфата меди (II)). Выделяется газ с характерным резким запахом - запах загорающейся спички (сернистый газ). Происходит растворение металла (меди).
С хромом:
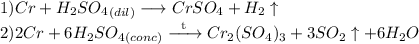
Обе реакции окислительно-восстановительные, не ионного обмена, поэтому ионных уравнений нет.
В первом случае, если кислота разбавленная. признак протекания реакции: раствор приобретает голубой оттенок (за счет образования сульфата хрома (II)).
Во втором случае, если кислота концентрированная. признак протекания реакции: раствор приобретает зеленоватый оттенок (за счет образования сульфата хрома (III)). Выделяется сернистый газ, имеющий характерный резкий запах загорающейся спички.
С карбонатом натрия:
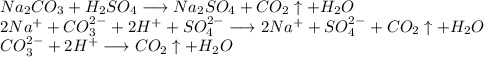
Признак протекания реакции: отсутствуют.
С гидроксидом железа (III):
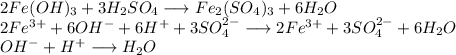
Признак протекания реакции: раствор приобретает желтоватый оттенок (за счет образования сульфата железа (III)). Происходит растворение осадка (гидроксида железа (III)).
С оксидом магния:
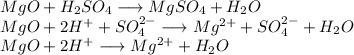
Признак протекания реакции: отсутствуют.
С бромоводородной кислотой (если обе кислоты концентрированные):
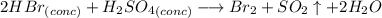
Это окислительно-восстановительная реакция, не ионного обмена, поэтому ионного уравнения нет.
Признак протекания реакции: выделяется газ с характерным запахом загорающейся спички. Раствор приобретает красно-бурый цвет (за счет образования брома). Также бром имеет едкий запах (что-то между хлором и йодом).
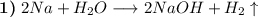
Выделяется водород. Реакция протекает бурно: пока она идет, металл будет "скакать" (будет казаться, словно он "катится") по поверхности воды благодаря выделяемому водороду, который будет его выталкивать; также будет выделяться большое количество энергии (тепла) (реакция экзотермическая). За счет образования гидроксид натрия раствор приобретает щелочную среду - это можно проверить, добавив фенолфталеин в раствор: он окрасит раствор в малиновый цвет.
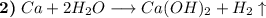
В целом будет тоже самое, что и с натрием, однако будет выделяться гораздо больше энергии (тепла) (это связано со свойствами самого кальция).
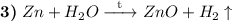
Эта реакция будет протекать при температуре 600-800 градусов по цельсию. При этом выделяется водород и образуется амфотерный нерастворимый оксид.