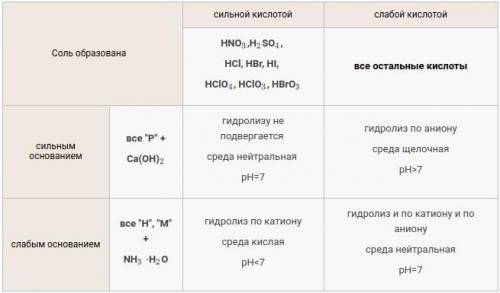
Ты выбрал(а) не очень удачный пример. Соли 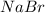 и
и 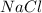 образованы сильным основанием (
образованы сильным основанием ( 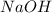 ) и сильными кислотами (
) и сильными кислотами ( 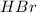 и
и 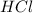 соответственно). Такие соли не влияют на кислотность среды, т.к. не проходит гидролиз:
соответственно). Такие соли не влияют на кислотность среды, т.к. не проходит гидролиз:
NaCl
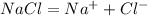 - соли в растворах диссоциируют необратимо.
- соли в растворах диссоциируют необратимо.
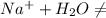 - гидролиз не идёт
- гидролиз не идёт
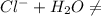 - гидролиз не идёт
- гидролиз не идёт
NaBr
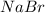 =
= 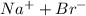 - соли в растворах диссоциируют необратимо.
- соли в растворах диссоциируют необратимо.
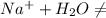 - гидролиз не идёт
- гидролиз не идёт
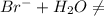 - гидролиз не идёт
- гидролиз не идёт
Приведу свой пример подобной задачи на вычисление pH:
Дано: 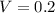 л ;
л ; 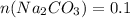 моль.
моль.
Найти: 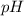 .
.
1) Найдём молярную концентрацию 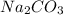 в растворе:
в растворе:
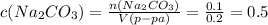 моль/л
моль/л
2) Запишем уравнение диссоциации соли:
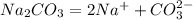 - соль в растворе необратимо диссоциирует.
- соль в растворе необратимо диссоциирует.
3) Гидролиз:
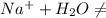
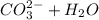 ⇄
⇄ 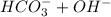 - в результате обратимого гидролиза карбонат-аниона образуются
- в результате обратимого гидролиза карбонат-аниона образуются 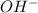 , которые влияют на кислотность среды.
, которые влияют на кислотность среды.
Далее нам понадобится константа основности 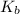 - справочная величина, обычно она дана в условии задачи.
- справочная величина, обычно она дана в условии задачи.
![K_{b} = \frac{[HCO_{3}^{-}][OH^{-}]}{[CO_{3}^{2-} ]}=3.12*10^{-5}](/tpl/images/0571/4965/963ce.png) ( скобками обозначаются концентрации соответствующих веществ в получившемся растворе )
( скобками обозначаются концентрации соответствующих веществ в получившемся растворе )
Зная константу основности, можно найти степень дисооциации:
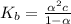 - Закон разбавления Оствальда.
- Закон разбавления Оствальда.
Найдём степень диссоциации альфа:
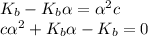 По формуле дискриминанта:
По формуле дискриминанта:
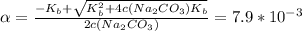
![[OH^{-}]=\alpha c(Na_{2}CO_{3})=3.95*10^{-3} M](/tpl/images/0571/4965/b4389.png) ( М - это моль/л )
( М - это моль/л )
![pOH=-lg[OH^{-}] =2.4](/tpl/images/0571/4965/1eae6.png)
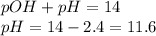
ответ: 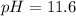 .
.
Советую почитать дополнительную литературу ( например, эта тема есть в бесплатном учебнике Фоксфорда ).
УДАЧИ! :)
С увеличением числа гидроксильных групп в молекуле вещества возрастает подвижность атомов водорода, т.е. увеличиваются кислотные свойства. Поэтому атомы водорода в многоатомных спиртах могут замещаться не только щелочными металлами, но и менее активными металлами. Получим гидроксид меди (II), путем сливания растворов гидроксида натрия и сульфата меди (II). Прильем полученный осадок к глицерину. Осадок гидроксида меди растворяется и образуется темно-синий раствор глицерата меди (II). Осадок гидроксида меди прильем к раствору этиленгликоля. Также образуется темно-синий раствор. Реакция с гидроксидом меди (II) является качественной реакцией на многоатомные спирты.