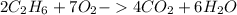
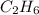 :
: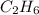 ) = 3 (г)
) = 3 (г)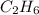 ) = 2 (моль)
) = 2 (моль)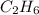 ) = 2*12+1*6 = 30 (г/моль)
) = 2*12+1*6 = 30 (г/моль)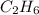 ) = 30*2 = 60 (г).
) = 30*2 = 60 (г).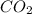 :
: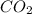 ) = x (г)
) = x (г)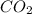 ) = 4 (моль)
) = 4 (моль)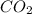 ) = 12+2*16 = 44 (г/моль)
) = 12+2*16 = 44 (г/моль)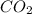 ) = 44*4 = 176 (г)
) = 44*4 = 176 (г)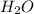 :
: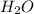 ) = y (г)
) = y (г)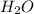 ) = 6 (моль)
) = 6 (моль)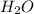 ) = 1*2+16 = 18 (г/моль)
) = 1*2+16 = 18 (г/моль)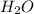 ) = 18*6 = 108 (г)
) = 18*6 = 108 (г)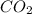 и
и 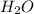 выделилось во время реакции. Для этого составляем пропорции:
выделилось во время реакции. Для этого составляем пропорции: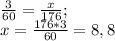 (г) - углекислого газа.
(г) - углекислого газа.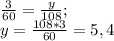 (г) - воды.
(г) - воды.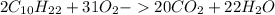
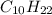 ) = 5 (г)
) = 5 (г)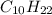 ) = 2 (моль)
) = 2 (моль)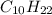 ) = 10*12+1*22 = 142 (г/моль)
) = 10*12+1*22 = 142 (г/моль)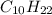 ) = 142*2 = 284 (г).
) = 142*2 = 284 (г).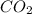 :
: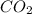 ) = x (г)
) = x (г)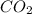 ) = 20 (моль)
) = 20 (моль)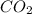 ) = 12+2*16 = 44 (г/моль)
) = 12+2*16 = 44 (г/моль)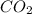 ) = 44*20 = 880 (г)
) = 44*20 = 880 (г)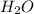 :
: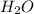 ) = y (г)
) = y (г)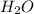 ) = 22 (моль)
) = 22 (моль)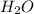 ) = 1*2+16 = 18 (г/моль)
) = 1*2+16 = 18 (г/моль)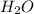 ) = 18*22 = 396 (г)
) = 18*22 = 396 (г)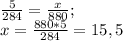 (г) - углекислого газа.
(г) - углекислого газа.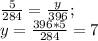 (г) - воды.
(г) - воды.