1) 2Fe(OH)-Fe2O3 + 3H3O
2)Ca3(PO4)2-4Cao+P2O5
3)4HNO3-2H2O+4No2+O2
4)2Cu(NO3)2-2CuO+4NO2+O2
х г 0,56 л
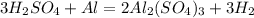
279 г 67,2 л
1. Найдем чистую массу кислоты,необходимую для образования 0,56 л водорода:
при взаимодействии 279 г кислоты выделяется 67,2 л водорода, а
при -- // -- // -- х г_____________________0,56 л, откуда
х=279*0,56/67,2=2,325 г
2. Учитывая,что полученная масса кислоты - это всего лишь 20% в растворе,тогда:
2,325 г кислоты - это 20%, а
у г раствора________100%, откуда у=2,325*100/20=11,625 или приблизительно 12 г
1)2Fe(OH)3 ---> Fe2O3 + 3H2O
2)Ca3(PO4)2 -->3 CaO + P2O5
3)4HNO3 ---> 2H2O + 4NO2 + O2
4)2Cu(NО3)2 ---> 2CuO + 4NO2 + O2