а) - 3)
б) - 1)
в) А-3; Б-2; Г - 1.
Объяснение:
а) Куда сместится равновесие: С(т)+ О₂(г) ⇄ СО₂(г) при увеличении давления?
ответ 3) не сместится.
Увеличение давления смещает равновесие в сторону меньших объемов газообразных веществ.
По реакции объемы газов в исходных веществах и продуктах реакции равны (по коэффициентам 1 объем O₂ в исходных веществах, 1 объем CO₂ в продуктах реакции). Равновесие не сместится при изменении давления.
б) Куда сместится равновесие: PCl₅(г) ⇄ PCl₃(г)+Cl₂(г) - Q при уменьшении температуры, если прямая реакция является эндотермической?
ответ 1) влево, в сторону исходных веществ.
Уменьшение температуры смещает равновесие в сторону экзотермической реакции, а у нас прямая реакция является эндотермической, следовательно равновесие сместится в сторону обратной реакции, т.е. в сторону исходных веществ.
в) N₂(г) + 3H₂(г) ⇄ 2NH₃(г) + 45,9 кДж
А) - 3) не происходит смещения равновесия
Катализатор не смещает равновесия, он ускоряет и прямую и обратную реакции
Б) - 2) смещается в сторону исходных веществ
Повышение концентрации аммиака сместит равновесие в сторону его разложения, т.е. влево, в сторону исходных веществ.
Г) - 1) смещается в сторону продуктов реакции
Повышение давления смещает равновесие в сторону меньших объемов.
Исходные вещества: 1 объем N₂(г) + 3 объема H₂(г) = 4 объема
Продукты реакции: 2 объема NH₃(г).
Объем продуктов реакции меньше.
1. Неметаллические свойства у кремния выражены сильнее,чем у:
3) алюминия
*Неметаллические и окислительные свойства возрастают слева направо по группам и снизу вверх по периодам.
2. Одинаковую степень окисления атомы хлора имеют в соединениях:
1) Cl2O7 и HClO4
*Cl2(+7)O7(-2), H(+)Cl(+7)O4(-2)
3. К хорошо растворимым в воде электролитам относится каждое из двух веществ:
2) MgCl2 и MgSO4
*MgCl2 -> Mg(2+) + 2Cl(-)
MgSO4 -> Mg(2+) + SO4(2-)
4.В реакцию с раствором серной кислоты вступает:
2)нитрат бария
*H2SO4 + Ba(NO3)2 -> BaSO4⬇️ + 2HNO3
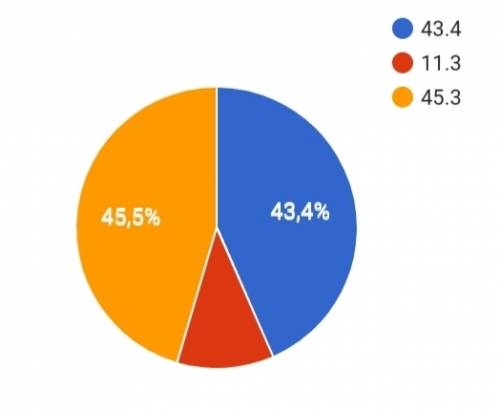
5 Mr(Na2CO3)=23×2+12+48=106
w(Na)=(46/106)×100%=43.4%
w(C)=(12/106)×100%=11.3%
w(O)=(48/106)×100%=45.3%