1)Уравнение реакции в общем виде: 4Ме + 3О2 = 2Ме2О3 Отношение количества вещества (Ме) к количеству вещества (Ме2О3) по уравнению реакции =4:2 или 2:1,следовательно (ню) Ме в 2 раза больше, чем Ме2О3. 2)Обозначим М (молярную массу Ме) через Х, тогда М (молярная масса оксида Ме2О3) будет равна 2Х +48 3)количество вещества Ме= м (масса 3г) / м (молярн. масса Х) = 3 / Х г/моль (а) количество вещества оксида = м (5,67г ) / М (2Х +48) =5,67 / 2х+48 г/моль (б) 4)Тогда, т. к. количество вещества Ме в 2 раза больше, следовательно, если значение (а) разделим на (б) = 2 3 / Х : (деление) 5,67 / 2Х +48 =2 3(2Х +48) :( 2Х ) х 5,67=2 6Х +144=11,34Х Х=27(г/моль) т. к. (Х) -молярная масса неизвестного металла, следовательно, это металл Аl(алюминий, степень окисления в оксиде у алюминия (+3),М =27 г моль.
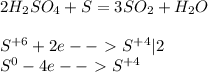
m(Al(NO3)3)= 21.3 g
m(NaOH) = 8 g
m(Al(OH)3)-?
M(Al(NO3)3)= 213 g/mol
n(Al(NO3)3)= m/M = 21.3 / 213 = 0.1 mol
M(NaOH)= 40 g/mol
n(NaOH) = m/M = 8/40 = 0.2 mol
8 X
Al(NO3)3+3NaOH--> Al(OH)3+3NaNO3
3*40 78
M(Al(OH)3)= 78 g/mol
m(Al(OH)3) = 8*78 120 = 5.2 g
ответ 5.2 г