Атомы:Ar;
Ионы:
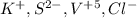
.
Объяснение:
Если имеется в виду,завершенный внешний уровень,то в нём присутствует только аргон. Если,завершённый уровень,то к ним можно отнести все элементы после аргона.
В ионы можно записать:
(cм.выше⤴)
Калий отдаёт один электрон,"разрушается" один уровень и в итоге на последнем уровне остаётся 8(максимум).
Сера принимает 2 электрона и завершает свой внешний третий уровень.
Ванадий отдаёт 5 электронов,"разрушается" один уровень и в итоге на последнем уровне остаётся 8(максимум).
Хлор принимает 1 электрон и завершает свой внешний третий уровень.
Качественные реакции
1. Сероводород дает темно-коричневый осадок сульфида висмута:
2BiCl3 + 3HSS - BisS3 + 6НС1.
2. Станнит щелочного металла выделяет на холоду черный осадок металлического висмута:
К 2 каплям раствора SnCl2 прибавляют на холоду столько 2 н. раствора едкой щелочи, чтобы первоначально выпавший осадок растворился с образованием станнита; к полученному раствору прибавляют каплю раствора соли висмута.
3. Бихромат и хромат калия дают желтые осадки бихромата висмутила:
2Bi (N03)3 + 2K2Cr04 + НаО - (BiO)3Crs07 + 4KN03 + 2HN03.
Для предупреждения растворяющего действия образующейся свободной азотной кислоты прибавляют значительный избыток хромата калия или ацетата натрия и тогда бихромат висмута выпадает количественно.
4. Вода гидролизует растворимые соли висмута и осаждает нерастворимые основные соли
В присутствии растворимых хлоридов, особенно после предварительной нейтрализации аммиаком или добавления ацетата натрия, выделяется осадок хлорида висмутила:
BiCIa + HsO - BiOGl -f 2HC1.
О дробной реакции восстановлением ионов висмута до металла см. работу М. Б. Щиголь . проба основана на образовании красных шестиугольных кристаллов Rb2[BiJ5] . 2,5H20. Предельное разбавление 1:10 000. Реакции мешает большое количество солей Sn2+, Pbs+. Sb3+; сурьма дает с указанным реактивом такой же осадок
с(AgNO3) =1,405 М = 1,405 моль/л
р(р-ра) = 1,194 г/мл
Найти:
ω(AgNO3)-?
m(AgNO3)-?
Сн-?
N(AgNO3)-?
Для расчета возьмем объем раствора 1 л
m(p-pa) = 1 л*1,194 кг/л = 1,194 кг = 1194 г
n(AgNO3)=1,405 моль/л*1 л = 1,405 моль
M(Ag(NO3) = 170 г/моль
m'(AgNO3) = n*M = 1,405 моль*170 г/моль = 238,85 г
ω(AgNO3) = 238.85 г/1194 г = 0,2 или 20%
m(H2O) = 1194 г - 238,85 г = 955,15 г
m=n(AgNO3)/m(H2O) = 1,405 моль/955,15 г = 0,0015 моль/кг (Н2О)
n(H2O) = m/M = 955.15 г/18 г/моль = 53,06 моль
Эм(AgNO3)= 170 г/моль, поэтому молярная концентрация (с) будет
совпадать с нормальностью (Сн) = 1,405N
N(AgNO3)= n(AgNO3)/(n(AgNO3)+n(H2O) =
= 1,405 моль/(1,405 моль+53,06 моль) = 1,405/54,465 = 0,026
N(H2O) = n(H2O)/(n(AgNO3)+n(H2O) = 53,06/54,465 = 0,974
ответ: массовая доля = 20%; моляльность = 0,0015 моль/кг
Н2О); нормальность = 1,405N, мольные доли AgNO3 = 0,026, воды =
0,974.