4P + 5O2 = 2P2O5
P2O5 + 3CaO = Ca3(PO4)2
Ca3(PO4)2 + 6HCl = 3CaCl2 + 2H3PO4
2H3PO4 -> P2O5 + 3H2O
2P2O5 -> 4P + 5O2
Количество моль смотрите по уравнению. Поскольку перед углекислым газом 5. А перед пентаном ничего то есть 1 моль. Количество газа в 5 раз больше чем количество пентана.Сначало пишите уравнение . Потом его нужно уравнять. Так чтобы количество углерода, водорода и кислорода было равным с двух сторон. Потом по массе нужно рассчитать количество моль данного вещества. По уравнению соотнести с количеством моль вещества которое нужно найти. Тут смотрите на коэффициент перед формулой вещества. Если нет коэффициента, то это один если стоит 2 то это 2. И так далее. После соотнесения количества вещества умножаем его на 22,4 л/моль это объем 1 моль любого газа при нормальных условиях
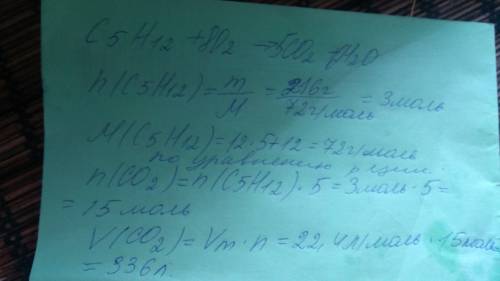
4P +5O2 = 2P2O5
6NaOH + P2O5 = 2Na3PO4 +3H2O
Na3PO4 + 3HCl = 3NaCl + H3PO4
2H3PO4 = P2O5 + 3H2O