1. А) N2 + 3Н2 = 2NН3 - соединения
Б) 3Mg + 2H3РО4 = Mg3(РО4)2 +3 H2↑ - замещения
В) 2Al(OH)3 = Al2O3 + 3H2O - разложения
Г) 2Cu2O = 4Cu + O2↑ - разложения
2. Na2CO3 + 2HCl = 2NaCl + H2O + CO2 - ионного обмена.
признаки: выделение воды и газа, индикатор показывает нейтральный pH (в первом растворе (Na2CO3) изначально показывалась щелочная среда, во втором (HCl) - кислая)
2 + + 2+2=2+2+ H2O + CO2
+ 2=H2O + CO2
3. 2Mg+O2=2MgO
Магний+кислород=оксид магния
MgO+2HCl=MgCl2+H2O
оксид магния+соляная кислота=хлорид магния +вода
MgCl2+2KOH=Mg(OH)2+2KCl
хлорид магния+гидроксид калия= гидроксид магния + хлорид калия
4. 2 + 6 =2 +3
--3e-> 3 2 окислитель
2-+2e-> 2 3 восстановитель
Объяснение:
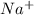

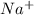
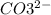

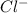
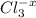


№1
1) CaH2 + 2H2O = Ca(OH)2 + 2H2↑
2) H2 + CuO = Сu + H2O (при нагревании)
3) Сu + 2H2SO4 = СuSO4 + SO2 + 2H2O
4)2CuSO4 + 4KI = 2CuI + I2 + 2K2SO4
№2
1. Составим уравнение реакции:
CuO + 2HCl = CuCl2 + H2O
2. Рассчитаем массу и количество вещества прореагировавшей соляной кислоты:
m (HCl) = 73 г · 0,2 = 14,6 г
v (HCl) = 14,6 г : 36,5 г/моль = 0,4 моль
3. Определим количество вещества и массу вступившего в реакцию оксида меди:
v (CuO) = ½ v (HCl) = 0,2 моль
m (CuO) = 0,2 моль · 80 г/моль = 16 г
Я извеняюсь, но я не знаю 3
M(PH3)=31+3*1=34
n(PH3)=m/M=3.6/34=0.10моль
V(PH3)=n*Vm=0.10*22.4=2.24л
N(PH3)=n*Na=0.10*6.02*10²³=0.602*10²³
DHe(PH3)=34/4=8.5
DH2(PH3)=34/2=17
Dвоздуха(PH3)=34/29=1.17