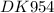Масса сульфата калия в смеси
m(K2SO4)=52,2 грамма
Массовая доля азота в смеси
W(N2)= 3,83 %
Объяснение:
Молярные массы солей по таблице Менделеева
M(K2SO4)=(39*2+32+16*4)=174 г/моль
M(KNO3)=(39+14+16*3)=101 г/моль
Определим массовую долю калия в каждом соединении разделив молярную массу атомов калия на молярную массу всей соли.
W(K)(K2SO4)= (39*2)/(39*2+32+16*4)=0,4482 W(K)(KNO3)=39/(39+14+16*3)=0,3861Вычислим массу калия в смеси по условию, обозначим количество солей в молях через переменные, составим два уравнения в системе и найдем количество каждой соли.
m(K)=72.4*0.431=31,2044 грамм
K2SO4 - X KNO3 - Y
X*174+Y*101=72.4
X*174*0.4482+Y*101*0.3861=31.2044
X=0.416-0.58Y
77.9868*(0.416-0.58Y)+38.9961Y=31.2044
32.4425088-45,232344Y+38.9961Y=31.2044
-6.236244Y=-1.2381088
Y=1.2381088/6.236244=0.1985
X=0.416-0.58*0.1985=0.3
Таким образом сульфата калия было 0,3 моль, нитрата калия 0,1985 моль. Найдем массу сульфата калия
m(K2SO4)=0.3*174=52.2 грамма
Вычислим массу нитрата калия, рассчитаем массовую долю азота и его долю в смеси.
m(KNO3)=0.1985*101=20.0485 грамма
W(KNO3)=14/101=0.1386
m(N2)=20.0485*0.1386=2,7787 грамма
W(N2)=2.7787/72.4=0.0383 - 3,83%
Для начала мы запишем все формулы из условии задачи и мы по закону Гесса мы найдем энтальпию реакции которое нам нужно найти:
Ca(OH)₂ → CaO + H₂O ΔН₁º = 65,3 кДж | × (-1)
Ca(OH)₂ + SiO₂ → CaSiO₃ + H₂O ΔН₂º = -23,3 кДж
CaO + SiO₂ → CaSiO₃ ΔН₃º - ?
Следовательно:
CaO + H₂O → Ca(OH)₂ ΔН₁º = -65,3 кДж
Ca(OH)₂ + SiO₂ → CaSiO₃ + H₂O ΔН₂º = -23,3 кДж
CaO + SiO₂ → CaSiO₃ ΔН₃º - ?
ΔН₃º = ΔН₁º + ΔН₂º = -65,3 кДж + (-23,3 кДж) = -65,3 кДж - 23,3 кДж = -88,6 кДж
ответ: ΔН₃º = -88,6 кДж
Решено от :