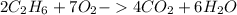
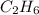 :
: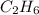 ) = 3 (г)
) = 3 (г)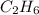 ) = 2 (моль)
) = 2 (моль)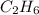 ) = 2*12+1*6 = 30 (г/моль)
) = 2*12+1*6 = 30 (г/моль)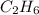 ) = 30*2 = 60 (г).
) = 30*2 = 60 (г).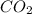 :
: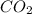 ) = x (г)
) = x (г)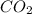 ) = 4 (моль)
) = 4 (моль)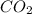 ) = 12+2*16 = 44 (г/моль)
) = 12+2*16 = 44 (г/моль)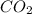 ) = 44*4 = 176 (г)
) = 44*4 = 176 (г)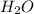 :
: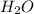 ) = y (г)
) = y (г)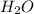 ) = 6 (моль)
) = 6 (моль)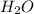 ) = 1*2+16 = 18 (г/моль)
) = 1*2+16 = 18 (г/моль)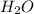 ) = 18*6 = 108 (г)
) = 18*6 = 108 (г)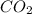 и
и 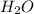 выделилось во время реакции. Для этого составляем пропорции:
выделилось во время реакции. Для этого составляем пропорции: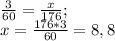 (г) - углекислого газа.
(г) - углекислого газа.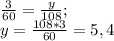 (г) - воды.
(г) - воды.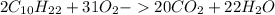
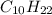 ) = 5 (г)
) = 5 (г)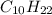 ) = 2 (моль)
) = 2 (моль)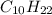 ) = 10*12+1*22 = 142 (г/моль)
) = 10*12+1*22 = 142 (г/моль)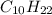 ) = 142*2 = 284 (г).
) = 142*2 = 284 (г).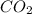 :
: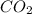 ) = x (г)
) = x (г)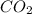 ) = 20 (моль)
) = 20 (моль)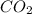 ) = 12+2*16 = 44 (г/моль)
) = 12+2*16 = 44 (г/моль)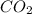 ) = 44*20 = 880 (г)
) = 44*20 = 880 (г)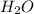 :
: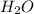 ) = y (г)
) = y (г)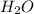 ) = 22 (моль)
) = 22 (моль)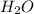 ) = 1*2+16 = 18 (г/моль)
) = 1*2+16 = 18 (г/моль)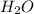 ) = 18*22 = 396 (г)
) = 18*22 = 396 (г)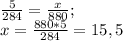 (г) - углекислого газа.
(г) - углекислого газа.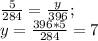 (г) - воды.
(г) - воды.
1.
Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород.
Несолеобразующие CO, N₂O, NO
Солеобразующие
Основные -это оксиды металлов, в которых последние проявляют небольшую степень окисления +1, +2 Na₂O; MgO; CuO
Амфотерные(обычно для металлов со степенью окисления +3, +4). В качестве гидратов им соответствуют амфотерные гидроксиды
ZnO; Al₂O₃; C₂O₃; SnO₂
Кислотные -это оксиды неметаллов и металлов со степенью окисления от +5 до +7 SO₂; SO₃; P₂O₅; Mn₂O₇; CrO₃
Химические свойства:
Основные оксиды:
с водой образуется основание:Na₂O + H₂O = 2NaOH
CaO + H₂O = Ca(OH)₂
При реакции с кислотой образуется соль и вода
MgO + H₂SO₄ –t°= MgSO₄ + H₂O
CuO + 2HCl –t°= CuCl₂ + H₂O
кислотные оксиды:
с водой образуется кислота:SO₃ + H₂O = H₂SO₄
P₂O₅ + 3H₂O = 2H₃PO₄
При реакции с основанием образуется соль и вода
CO₂ + Ba(OH)₂ = BaCO₃ + H₂O
SO₂ + 2NaOH = Na₂SO₃ + H₂O
2.
Основания - сложные вещества, в которых атомы металлов соединены с одной или несколькими гидроксильными группами (с точки зрения теории электролитической диссоциации, основания - сложные вещества, при диссоциации которых в водном растворе образуются катионы металла (или NH4+) и гидроксид - анионы OH-). Классификация. Растворимые в воде (щёлочи) и нерастворимые. Амфотерные основания проявляют также свойства слабых кислот
1. Действие на индикаторы:
.лакмус - синий
метилоранж - жёлтый
фенолфталеин - малиновый
2. Взаимодействие с кислотными оксидами.
2KOH + CO₂ = K₂CO₃ + H₂O
3. Взаимодействие с кислотами (реакция нейтрализации)
NaOH + HNO₃ = NaNO₃ + H₂O
Cu(OH)₂ + 2HCl = CuCl₂ + 2H₂O
4. Обменная реакция с солями:
Ba(OH)₂ + K₂SO₄ = 2KOH + BaSO4
3KOH+Fe(NO₃)₃ =Fe(OH)₃ + 3KNO₃
5. Термический распад.
Cu(OH)₂ –t°= CuO + H₂O
3.
Кислоты - сложные вещества, состоящие из атомов водорода и кислотного остатка. (С точки зрения теории электролитической диссоциации: кислоты - электролиты, которые при диссоциации в качестве катионов образуют только H+).
Бескислородные:
HCl - хлористоводородная (соляная)
HBr - бромистоводородная
HI - йодистоводородная
H2S - сероводородная
Кислородсодержащие: HNO3 – азотная
H₂SO₃ - сернистая
H₂SO₄ – серная
H₂CO₃ - угольная
H₂SiO₃ - кремниевая
H₃PO₄ - ортофосфорная
1. Действие на индикаторы. лакмус - красный
метилоранж - розовый
2. Взаимодействие с основаниями (реакция нейтрализации):
H₂SO₄ + 2KOH = K₂SO₄ + 2H₂O
2HNO₃ + Ca(OH)₂ = Ca(NO₃)₂ + 2H₂O
3. Взаимодействие с основными оксидами:
CuO + 2HNO₃ –t°= Cu(NO₃)₂ + H₂O
4. Взаимодействие с металлами: Zn + 2HCl = ZnCl₂ + H₂
2Al + 6HCl =2AlCl₃ + 3H₂
4.
Соли - сложные вещества, которые состоят из атомов металла и кислотных остатков. Это наиболее многочисленный класс неорганических соединений.
Химические свойства:
1. Термическое разложение. CaCO₃ = CaO + CO₂
2Cu(NO₃)₂ = 2CuO + 4NO₂ + O₂
NH₄Cl = NH₃ + HCl
2. Обменные реакции с кислотами, основаниями и другими солями.
AgNO₃ + HCl =AgCl + HNO₃
Fe(NO₃)₃ + 3NaOH = Fe(OH)₃ + 3NaNO₃
CaCl₂ + Na₂SiO₃= CaSiO³ + 2NaCl
4. Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона. 2KMnO₄ + 16HCl = 2MnCl₂+ 2KCl + 5Cl₂ + 8H₂O
LiOH- основание, щелочь
P₂O₅, - оксид фосфора(V). кислотный оксид
Cu(NO₃)₂ - соль. нитрат меди(II)