Ca(OH)2 → CaCO3 → Ca(HCO3)2 → CaCO3
1) Ca(OH)2 + CO = CaCO3 + H2
2) CaCO3 + CO2 + H2O = Ca(HCO3)2
3) Ca(HCO3)2 + Ca(OH)2 = 2CaCO3↓ + H2O
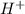 . Наличие водорода можно доказать при взаимодействии с активным металлом (магний, цинк).
. Наличие водорода можно доказать при взаимодействии с активным металлом (магний, цинк). 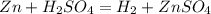

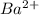 . Образуется белый осадок сульфата бария, нерастворимый в воде.
. Образуется белый осадок сульфата бария, нерастворимый в воде. 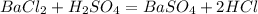
n(H2SO4) = 9,8 г/98 г/моль = 0.1 моль
n Н2SO4 относится к n ВаSO4 как 1 к 1 => n(BaSO4) =0.1 моль
m(BaSO4)= 0.1моль × 223 г/моль = 22.3 г