Во всех заданиях даны массы газов и сами газы. Вообще, V находится по формуле 1)V=n*Vm, где n – кол-во газа, а Mr – молярная масса газа. А кол-во рассчитаем так: 2)n=m/Mr. Теперь подставим это выражение в 1 формулу и получим V=m*Vm/Mr. Будем использовать полученную формулу в решении следующих задач.
А) Масса аммиака равна 1,7 грамм. V(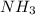 )=m(
)=m(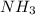 )*Vm/Mr(
)*Vm/Mr(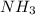 )=1,7*22,4/17=2,24 л.
)=1,7*22,4/17=2,24 л.
Б) Масса водорода равна 1 грамм. Рассчитаем объем:
V(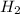 )=m(
)=m(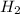 )*Vm/Mr(
)*Vm/Mr(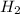 )=1*22,4/2=11,2 л.
)=1*22,4/2=11,2 л.
В) Масса хлора равна 7,1 грамм. Объем равен:
V(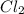 )=m(
)=m(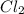 )*Vm/Mr(
)*Vm/Mr(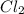 )=7,1*22,4/71=2,24 л.
)=7,1*22,4/71=2,24 л.
Г) Масса хлороводорода равна 7,3 грамм. Его объем равен:
V(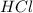 )=m(
)=m(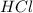 )*Vm/Mr(
)*Vm/Mr(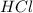 )=7,3*22,4/36,5=4,48 л.
)=7,3*22,4/36,5=4,48 л.
1)BaCl2(тверд.) + H2SO4(конц.) = BaSO4↓ + 2HCl↑
Полная
форма: 2H+ + SO42− + Ba2+ + 2Cl− = 2H+ + 2Cl− + BaSO4
Краткая
форма: SO42− + Ba2+ = BaSO4
2) K2CO3 + Ca(OH)2(насыщ.) = CaCO3↓ + 2KOH
Полная
форма: 2K+ + CO32− + Ca2+ + 2OH− = CaCO3↓ + 2K+ + 2OH−
Краткая
форма: CO32− + Ca2+ = CaCO3↓
3)2NaOH + H2SO4(разб.) = Na2SO4 + 2H2O
Полная
форма: 2Na+ + 2OH− + 2H+ + SO42− = 2Na+ + SO42− + 2H2O
Краткая
форма: 2OH− + 2H+ = 2H2O
4) K2CO3 + 2HCl(разб.) = 2KCl + CO2↑ + H2O
Полная
форма: 2K+ + CO32− + 2H+ + 2Cl− = 2K+ + 2Cl− + CO2↑ + H2O
Краткая
форма: CO32− + 2H+ = CO2↑ + H2O
1) Рассчитываем массы 1 моля каждого из оксидов:
- М(Fe₂O₃) = 2*55,849 + 3*15,999 = 159,695 г/моль
- М(CuO) = 63,546 + 15,999 = 79,545
2) Определяем массовые доли кислорода в каждом из оксидов:
- в Fe₂O₃ ω = 3*15,999/159,695 = 0,3005
- в CuO ω = 15,999/79,545 = 0,2011
3) Обозначим массу Fe₂O₃ в смеси через Х г, тогда масса CuO в смеси равна (56 - Х) г
4) Составляем уравнение:
0,3005*Х + 0,2011(56 - Х) = 0,257*56
0,3005Х + 11,2616 - 0,2011Х = 14,392
0,0994Х = 3,1304
Х = 31,49
ответ: 31,49 г