1)Оксиды: Na2O - оксид натрия, SiO2 - оксид кремния, CO2 - углекислый газ
Основания: Сa(OH)2 - гидроксид кальция, LiOH - гидроксид лития
Кислоты: HNO3 - азотная кислота, H2CO3 - угольная кислота
Соли: ZnS - сульфид цинка, MgCO3 - карбонат магния, BaSO4 - сульфат бария, Na2HPO4 - гидрофосфат натрия, NaNO3 - нитрат натрия, KCl- хлорид калия, AlPO4 - фосфат алюминия
2) 2Mg+O2=2MgO cоединение
MgO+2HNO3=Mg(NO3)2+H2O обмен
Mg(NO3)2+2KOH=Mg(OH)2осадок + 2KNO3 обмен
3) H2SO4+2NaOH=Na2SO4+2H2O
H2SO4+CuO=CuSO4+H2O
H2SO4 + MgCO3= MgSO4 + CO2 + H2O
4) FeCl3 K2CO3 Cu(OH)2 Ag2O Ca(NO3)2 K2SO3 BaSiO2 KBr H2S MnO2 Na2SO4 Al(NO3)3 HCl
5) H3PO4+3AgNO3=Ag3PO4осадок+3HNO3
419*53,2:98= 227
6) Ca(OH)2+H2SO4=CaSO4+H2O
n(CaOH)=18.3/74(молярная масса гидроксида кальция)=0,247 моль
коэффициенты здесь все по 1, значит и химическое кол-во соли будет 0,247 моль
m(CaSO4)=0.247*136(40+32+64)=33.59=33.6г
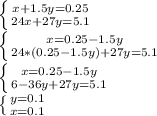 . Зная количество вещества каждого металла, можем найти массу этих металлов: m (Mg)=2.4 грамм, а m (Al)=2.7 грамм.
. Зная количество вещества каждого металла, можем найти массу этих металлов: m (Mg)=2.4 грамм, а m (Al)=2.7 грамм.
С2Н5ОН + 2CuO --> СН3СНО + Cu2O + H2O
Я взял оксид меди, так как это слабый окислитель, и его хватит чтобы окислить этанол до этаналя.
А вот чтобы получить уксусную кислоту из этанола, можно взять более жёсткий окислитель, например KMnO4.
C2H5OH -->(над стрелочкой KMnO4) CH3COOH.
Если вы пишите окислитель над стрелочкой, то все продукты реакции можете не писать, а просто основное полученное вещество.
Полную реакцию вы можете поискать в интернете, если вам нужны все продукты реакции.