Уравнение реакции:
Zn (M = 65 г/моль) + H2SO4 (M = 98 г/моль) = ZnSO4 (M = 161 г/моль) + H2 (M = 2 г/моль);
Пусть масса полученного р-ра = 100 г., тогда масса ZnSO4 = 10 г., что составляет 10/161 = 0.0621 моль;
помимо ZnSO4, образовался H2 массой 2×0.0621 = 0.1242 г;
в реакцию вступили цинк массой 65×0.0621 = 4.0365 г. и H2SO4 массой 98×0.0621 = 6.0858 г.;
масса полученного р-ра = (масса исх. р-ра H2SO4+масса цинка)-масса H2 = 100 г., тогда масса исх. р-ра = (100+0.1242)-4.0365 = 96.0877 г.;
w H2SO4 в исх. р-ре = 6.0858/96.0877 ≈ 0.06334 или 6.334%;
ответ: 6.3.
1) 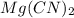 ⇒
⇒ 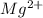 + 2
+ 2 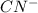
Гидролиз протекает и по катиону и по аниону, т.к соль образована слабым основанием и слабой кислотой.
Протолитическая форма:
Гидролиз по катиону:
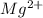 + 4
+ 4 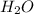 ⇔
⇔ ![[Mg(H_{2} O)_{4})]^{2+}](/tpl/images/2101/8856/6e7cd.png)
![[Mg(H_{2} O)_{4})]^{2+} + H_{2} O](/tpl/images/2101/8856/78463.png) ⇔
⇔ ![[Mg(OH)(H_{2}O)_{3}]^+ + H_{3}O^{+}](/tpl/images/2101/8856/88773.png)
![[Mg(OH)(H_{2}O)_{3}]^+ + H_{2}O](/tpl/images/2101/8856/a689f.png) ⇔
⇔ ![[Mg(OH)_{2}(H_{2}O)_{2}] + H_{3}O^{+}](/tpl/images/2101/8856/6abe3.png)
Краткое ионное уравнение:
1 ступень: 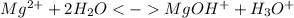
2 ступень: 
Гидролиз по аниону:
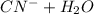 ⇔
⇔ 
Молекулярное ур-е: 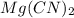 + 2
+ 2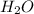 ⇔
⇔ 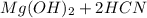 , среда слабощелочная, т.к константа диссоциации основания Mg(OH)2 > константы диссоциации кислоты HCN.
, среда слабощелочная, т.к константа диссоциации основания Mg(OH)2 > константы диссоциации кислоты HCN.
2) Rb₂SO₃ ⇒ 2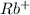 +
+ 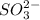
Соль образована сильным основанием и слабой кислотой, гидролиз идет по аниону.
Краткое ионное уравнение гидролиза:
Гидролиз по аниону:
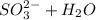 ⇔
⇔ 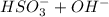 - первая ступень
- первая ступень
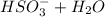 ⇔
⇔ 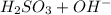 - вторая ступень
- вторая ступень
Молекулярное ур-е: 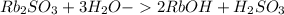
Среда щелочная, т.к в итоге выделились гидроксид ионы, pH>7. Также степень диссоциации основания > степени диссоциации кислоты, из чего можно сделать вывод, что среда - кислая.
3) 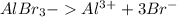
Соль образована слабым основанием и сильной кислотой, поэтому гидролиз идет по катиону.
Протолитическая форма:
![Al^{3+}+6H_2O [Al(H_2O)_6]^{3+}](/tpl/images/2101/8856/df26b.png)
![[Al(H_2O)_6]^{3+} + H_2O [Al(OH)(H_2O)_5]^{2+} + H_3O^+](/tpl/images/2101/8856/9396d.png)
![[Al(OH)(H_2O)_5]^{2+} + H_2O [Al(OH)_2(H_2O)_4]^{+} +H_3O^+](/tpl/images/2101/8856/c0d01.png)
![[Al(OH)_2(H_2O)_4]^+ + H_2O [Al(OH)_3(H_2O)_3] + H_3O^+](/tpl/images/2101/8856/62398.png)
Молекулярное ур-е: 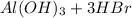
Сокращенное ионное уравнение:
1 ступень: 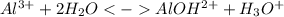
2 ступень: 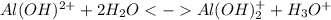
3 ступень: 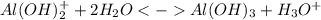
Среда кислая из-за образования ионов гидроксония. Также константа диссоциации основания < степени диссоциации кислоты, это также подтверждает, что среда кислая.
4) 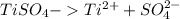
Соль образована слабым основанием и сильной кислотой, гидролиз протекает по катиону:
Протолитическая форма:
![Ti^{2+} + 4H_2O - [Ti(H_2O)4]^{2+}](/tpl/images/2101/8856/abb19.png)
![[Ti(H_2O)_4]^{2+}+H_2O [Ti(OH)(H_2O)_3]^++H_3O^+](/tpl/images/2101/8856/852e0.png)
![[Ti(OH)(H_2O)_3]^++H_2O [Ti(OH)_2(H_2O)_2] + H_3O^+](/tpl/images/2101/8856/d3bc2.png)
Молекулярное ур-е: 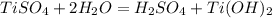
Сокращенное ионное уравнение:
1 стадия: 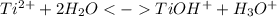
2 стадия: 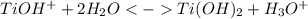
Среда кислая из-за присутствия ионов гидроксония. Также степень диссоциации основания < степени диссоциации кислоты, следовательно среда будет кислая, pH<7.
Предельное число электронов на внешнем уровне для каждого элемента, кроме водорода и гелия равно 8.