Дано:
w (CH3COOH) = 95%
n (CH3COH) = 13,5 моль
m (Ag2O) = 12 г
Найти: m пр (CH3COOH)
Определим окислитель и восстановитель в реакции:
+1 +1 +3 0
CH3COH + Ag2O = CH3COOH + 2Ag↓
1|C[+1] -2e = C[+3] | восстановитель, окисление
2| Ag[+1] +1e = Ag[0] | окислитель, восстановление
Рассчитаем вещество в недостатке:
13,5 моль 12 г х г
CH3COH + Ag2O = CH3COOH + 2Ag↓
1 моль 232 г 60 г
n = m\M
n (CH3COH) = 13,5 моль (избыток)
n (Ag2O) = 12 \ 232 = 0,05 моль (недостаток)
2) вычислим массу кислоты:
12 г – х г
232 г – 60 г
х = 12 г ∙ 60 г\ 232 г = 3,1 г
3)Вычислим практический массу продукта:
m(пр) = m(теор) ∙ w(вых)\ 100% =
m(пр) (CH3COOH) = 3,1 ∙ 95%\ 100% = 2,95 г
ответ: m пр (CH3COOH) = 2,95 г
Массовая доля соли в получившемся растворе составляет 19,76%
Объяснение:
Дано:
m (CaC₂) = 12,8 г
V (р-ра HBr) = 174 мл
w (HBr) = 20 %
ρ (р-ра HBr) = 1,12 г/мл
Найти:
w (р-ра CaBr₂)
CaC₂ + 2HBr = CaBr₂ + C₂H₂↑
1) Найдем массу и количество вещества HBr в растворе:
m(р-ра HBr) = V(HBr) ∙ ρ (р-ра HBr) = 174 мл ∙ 1,12 г/мл = 194,88 г
m(HBr) = m(р-ра) ∙ w(р-ра) \ 100%
m(HBr) = 194,88 г ∙ 0,2 = 38,98 г
Молярная масса M(HBr) = 1 + 80 = 81 г/моль
Количество вещества найдем по формуле 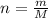
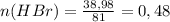 (моль)
(моль)
2) Найдем количество вещества карбида кальция:
Молярная масса M(CaC₂) = 40 + 2*12 = 64 г/моль
Количество вещества
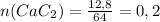 (моль)
(моль)
3) Соотношение реагирующих веществ:
По уравнению реакции карбид кальция реагирует с бромистоводородной кислотой в отношении 1 моль : 2 моль. Вещества даны в отношении 0,2 моль CaC₂ к 0,48 моль HBr. ⇒ Бромистоводородная кислота дана в избытке. Расчет задачи ведем по недостатку, т.е. по карбиду кальция.
По уравнению реакции из 1 моль CaC₂ образуется 1 моль бромида кальция, значит из 0,2 моль CaC₂ образуется 0,2 моль соли CaBr₂.
Найдем массу образовавшейся соли CaBr₂:
M(CaBr₂) = 40 + 2*80 = 200 г/моль
m(CaBr₂) = n*M = 0,2 моль * 200 г/моль = 40 г.
4) Найдем массовую долю соли CaBr₂ в растворе:
Рассчитаем массу выделившегося из раствора ацетилена. По уравнению реакции из 1 моль CaС₂ образуется 1 моль C₂H₂, а из 0,2 моль CaС₂ образуется 0,2 моль C₂H₂.
M(C₂H₂) = 2 * 12 + 2 = 26 г/моль
m(C₂H₂) = n*M = 0,2 моль * 26 г/моль = 5,2 г.
Масса раствора m(р-ра) = m(CaС₂) + m (HBr) - m(C₂H₂) = 12,8 г + 194,88 г - 5,2 г = 202,48 г.
Массовая доля соли в полученном растворе:
w(CaBr₂) = (m(соли) ∙ 100%) / m(р-ра) = (40 г ∙ 100%) / 202,48 г = 19,76%
ответ: массовая доля соли в получившемся растворе составляет 19,76%.
Применение этена
Основное направление использование этилена — промышленный органический синтез таких соединений как галогенопроизводные, спирты (этанол, этиленгликоль), уксусный альдегид, уксусная кислота и др. Кроме этого данное соединение в производстве полимеров.
Гидрирование, получение этана:
CH₂=CH₂ + H₂→ CH₃-CH₃ (kat = Pt).
Галогенирование, получение галогенопроизводных:
CH₂=CH₂ + Br₂→ BrCH-CHBr.
Гидратация, получение этилового спирта:
CH₂=CH₂ + H-OH → CH₃-CH-OH (H+, t°).
Полимеризация, получение полимеров:
nCH₂=CH→ -[-CH₂-CH₂-]-n (kat, t°).
Окисление получение мнгоатомного спирта- этиленгликоля, простых эфиров:
CH₂=CH₂ + 2KMnO₄ + 2KOH → HO-CH₂-CH₂-OH + 2K₂MnO₄;
2CH₂=CH₂ + O₂ → 2C₂OH₄ (эпоксид) (kat = Ag,t°);
Горение получение тепла: C₂H₄ + 2O₂→ 2CO₂ + 2H₂O+Q