ν=0,52 моль
Для начала нужно записать реакцию нейтрализации соляной кислоты:
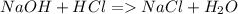
Как видно из уравнения реакции, на нейтрализацию одной молекулы кислоты нужна одна молекула щелочи, а значит количество вещества NaOH равняется количеству вещества HCl. Раствор имеет массу 126,3 г, однако кислотой из них являются только 15%. Значит всего в растворе кислоты: 0,15*126,3=18,945 г. Определим теперь, какое количество вещества соответствует такой массе кислоты. Для этого массу нужно поделить на молярную массу ν=18,945/(1+35,5)=0,52 моль.
Поскольку цвета индикаторов ярко отличаются только в тех средах, где уровень pH отличается значительно. Разница между кислотной и щелочной средой огромна. А вот если среда не является сильно щелочной или сильно кислотной, то цвет индикатора либо будет неоднозначен, либо будет зависеть от других факторов.
А при изучении, например, сильной и слабой кислот индикатор может иметь одинаковый или почти одинаковый цвет.
Таким образом, индикаторы только дают только примерное представление об уровне pH и характера вещества (кислота, щёлочь или соль).
Объяснение:
х- маса N2, (8-х) – маса СО2. Об'єм N2= m /М *22,4=х/28*22,4=22,4х/28
Об'єм СО2 = (8-х)/ 44*22,4= 22,4 (8-х)/ 44=(179,2-22,4х)/44
Об'єм газів=4,48 л. Знаходимо масу N2
22,4х/28 + (179,2-22,4х)/44=4,48
985,6х+ 5017,6-627,2х =5519,36
358,4х=501,76
х=1,4 г N2
W(N2)=1,4/8=0,175*100%=17,5%