Задание 1:
1) Сложные вещества, состоящие из двух элементов, один из которых кислород - ОКСИДЫ
2) Сложные вещества, состоящие из разных по виду атомов химических элементов - СЛОЖНЫЕ ВЕЩЕСТВА
3) Вещества, состоящие из ионов металла и гидроксильных групп - ОСНОВАНИЯ
4) Вещества, состоящие из ионов металла и кислотных остатков - СОЛИ
5) Вещества-распознаватели кислот и щелочей - ИНДИКАТОРЫ
Задание 2:
1) в глаз попала кислота - промыть глаза большим количеством воды около 30 минут
2) если на кожу попала кислота - промыть большим количеством воды, после промыть раствором пищевой соды
3) ожог щелочами - промыть водой, после раствором лимонной, уксусной или борной кислоты
Задание 3:
А - 4
Б - 5
В - 1
Г - 2
Д - 3
Задание 4:
А. Лишнее Cu(OH)₂, потому что из всех перечисленных оснований оно единственное не растворимо в воде
Б. Лишнее LiOH, потому что из всех перечисленных оснований в этом основании единственный металл имеет степень окисления +1, когда все остальные +2
В. Лишнее Al(OH)₃, потому что из всех перечисленных оснований, во-первых, это нерастворимое, во-вторых, металл в нем имеет степень окисления +3, когда все остальные +1
Задание 5:
а) оксиды: CO₂ (оксид углерода (IV)), Al₂O₃ (оксид алюминия), Na₂O (оксид натрия)
б) основания: NaOH (гидроксид натрия или едкий натр), Fe(OH)₃ (гидроксид железа (III)), Ba(OH)₂ (гидроксид бария)
в) кислоты: HNO₃ (азотная кислота), H₂CO₃ (угольная кислота)
г) соли: K₂SO₄ (сульфат калия), Mg₃(PO₄)₂ (фосфат магния), CuCl₂ (хлорид меди)
Задание 6:
Формула: 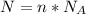 , где
, где 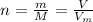 - количество вещества (моль);
- количество вещества (моль); 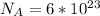 - число Авогадро (1/моль).
- число Авогадро (1/моль).
M - молярная масса (считается как сумма атомных масс элементов, входящих в вещество; атомные массы даны в таблице Менделеева)
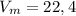 - молярный объем, одинаковый для всех газов при н.у. (л/моль)
- молярный объем, одинаковый для всех газов при н.у. (л/моль)
Считаем:
а) 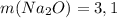 г
г
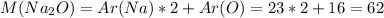 г/моль
г/моль
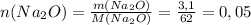 моль
моль
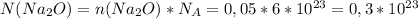 молекул
молекул
б) 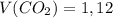 л
л
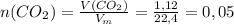 моль
моль
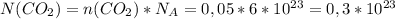 молекул
молекул
Объяснение:
4.
1) 2) 3)
а) CH₃-CH₃ → CH₃-CH₂-Cl → CH₂=CH₂ → HO-CH₂-CH₂-OH
1) CH₃-CH₃ + Cl₂ (hv - свет) → CH₃-CH₂-Cl + HCl
2) CH₃-CH₂-Cl + KOH (спирт) → CH₂=CH₂ + KCl + H₂O
3) 3CH₂=CH₂ + 2KMnO₄ + 4H₂O → 3HO-CH₂-CH₂-OH + 2MnO₂↓ + 2KOH
1) 2) 3) 4) б) HO-CH₂-CH₂-OH → Cl-CH₂-CH₂-Cl → CH≡CH → CH₃-CH₃ →
5) 6) 7)
CH₃-CH₂-Cl → CH₃-CH₂-OH → CH₂=CH₂ → HO-CH₂-CH₂-OH
1) HO-CH₂-CH₂-OH + 2HCl → Cl-CH₂-CH₂-Cl + 2H₂O
2) Cl-CH₂-CH₂-Cl → CH≡CH + 2HCl
3) CH≡CH + 2H₂ → CH₃-CH₃
4) CH₃-CH₃ + Cl₂ → CH₃-CH₂-Cl + HCl
5) CH₃-CH₂-Cl + H₂O → CH₃-CH₂-OH + HCl
6) CH₃-CH₂-OH → CH₂=CH₂ + H₂O
7) 3CH₂=CH₂ + 2KMnO₄ + 4H₂O → 3HO-CH₂-CH₂-OH + 2MnO₂↓ + 2KOH
Химические свойства.
1. Концентрированная серная кислота является сильным окислителем. Окислительно-восстановительные реакции требуют нагревания, а продуктом реакции в основном является SO2.
S + 2H2SO4 = 3SO2 + 2H2O
2. С металлами вступает в реакцию по-разному в зависимости от концентрации. Разбавленная серная кислота взаимодействует со всеми металлами, стоящими в ряду напряжений до водорода. Концентрированная серная кислота окисляет все металлы, стоящие в ряду напряжений, и серебро в том числе.
3. Разбавленная серная кислота взаимодействует с основаниями, основными и амфотерными оксидами, солями.
Серная кислота образует два вида солей: средние (сульфаты) и кислые (гидросульфаты).