
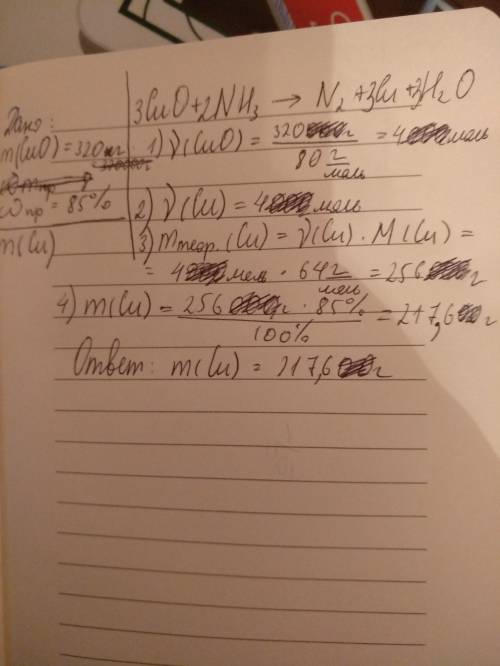
дано
m(CuO) - 320 kg
η(Cu) = 85%
m практ (Cu)-?
3CuO+2NH3-->3Cu+N2+3H2O
M(CuO) = 80 kg/kmol
n(CuO) = m/M = 320 / 80 = 40 kmol
3n(CuO) = 3n(Cu)
n(Cu) = 40 kmol
M(Cu) = 64 kg/kmol
m теор (Cu) = n(Cu) * M(Cu) = 40*64 = 256 kg
mпракт(Cu) = m(Cu) * η(Cu) / 100% = 256 * 85% / 100% = 217.6 kg
ответ 217.6 кг
Оксид – соединение, где в реакцию вступают два элемента, и один из них кислород. Но, как оказалось, все не так просто. В реакциях с кислородом появляются не только оксиды, но и соли, и кислоты. Например: перекись водорода H2O2 является кислотой, а BaO2 – солью. Что интересно, степень окисления здесь -1. А в остальных соединениях с кислородом +2, кроме OF2, где степень окисления составляет -2. Значит, если быть точнее, оксид – это соединение элементов с О2, степень окисления которого -2.
Получение оксидов в химии
Любой оксид можно получить несколькими .
Получение оксида окислением простых веществ. Реакции на примере металлов и неметаллов:
металлы: 2Ca+O2=2CaO; 2Mg+O2=2MgO; 2Cu+O2=CuO;
неметаллы: S+O2=SO2; 4P+5O2=2P2O5; C+O2=CO2.
Получение оксида окислением сложных веществ. Реакции на примере бинарных и водородных соединений:
Водородные соединения
2H2S+3O2=2H20+2SO2;
Бинарные соединения
CS2+4O2=CO2+2SO3.
Оксиды можно получить, когда разлагаются вещества, такие как соли, основания и кислоты:
разложение соли: CaCO3=CaO+CO2;
разложение основания: Ca(OH)2=CaO+H2O;
разложение кислоты: H2SiO3=H2O+SiO2.
Получение оксида окислением кислорода и озона:
окисление кислорода: 2SO2+O2=2SO3;
окисление озона: NO+O3=NO2+O2.
Свойства оксидов
Оксиды бывают основные, амфотерные и кислотные. Рассмотрим их свойства.
Основные оксиды – это оксиды металлов, степень окисления которых либо +1, либо +2, и валентность которых 1, 2 или же 3 (только некоторые).
Пример основных оксидов: CaO, BaO, MgO, HgO, CuO и др.
Свойства основных оксидов
Основные оксиды, металлы которых в 1А-группе, реагируют с водой.
CaO+H2O=Ca(OH)2;
Li2O+H2O=2LiOH.
Реагируют с кислотами с образованием соли и H2O.
CaO + H2SO4 = CaSO4 + H2O;
Li2O+2HCl=2LiCl+H2O.
Также основные оксиды реагируют с другими двумя видами оксидов.
BaO+CO2=BaCO3;
FeO+SO3=FeSO4;
BaO+Al2O3=Ba(AlO2)2.
Возможно окисление кислородом.
4FeO+O2=2Fe2O3.
Реагируют с солями:
MgO+MgCl2+H2O=2Mg(OH)Cl;
CaO+Ca(HCO3)2=2CaCO3+H2O.
Кислотные оксиды, они же ангидриды, – оксиды, у которых есть свои соответствующие кислоты. Они могут быть газами, жидкими веществами или же твердыми. Степень окисления кислотных оксидов от +4 до +7.
Свойства кислотных оксидов
Реагируют с водой, кроме SiO2. Образуется кислота.
SO3+H2O=H2SO4;
N2O5+H2O=2HNO3;
SO2+H2O=H2SO3.
Взаимодействуют с основаниями:
SO3+Ca(OH)2=CaSO4+H2O;
SiO2+2KOH=K2SiO3+H2O.
Реагируют с амфотерными и основными оксидами:
3SO3+Al2O3=Al2(SO4);3CO3+CaO=CaCO3.
Реагируют с солями:
CO2+CaCO3+H2O=Ca(HCO3)2 (кислая соль);
SiO2+K2CO3=K2SiO3+CO2.
Амфотерные оксиды – оксиды, которые могут проявлять сразу основные и кислотные свойства. Степень окисления элементов, вступающих в реакцию с кислородом, в амфотерных оксидах либо +3, либо +4.
Свойства амфотерных оксидов
Оксиды данного вида не вступают в реакцию с водой.
Реагируют с кислотами:
ZnO+2HCl=ZnCl2+H2O;
Al2O3+6HNO3=2Al(NO3)3+3H2O.
Взаимодействуют с основными и кислотными оксидами:
Al2O3+K2O=2KAlO2;
Al2O3 + 3SO3 = Al2(SO4)3.
Вступают в реакцию с основными или кислотными гидроксидами:
ZnO+2KOH=K2ZnO2+H2O;
ZnO+H2SO4=ZnSO4+H2O.
Объяснение:
думаю так это правило
1)Кристаллическая решётка — пространственный каркас,который получится при соединении частиц условными линиями.
2)Типы кристаллических решеток : ионная, металлическая, атомная, молекулярная.
3)а) вещества твёрдые, тугоплавкие, нелетучие, хорошо растворяются в воде;
б)вещества имеют высокую прочность и твёрдость, очень высокие температуры плавления и кипения,практически нерастворимы в воде;
в)вещества имеют небольшую прочность и твёрдость, низкие температуры плавления и кипения, летучи, некоторые молекулярные вещества имеют запах.
4)а) NaCI,BaSO4,NaOH
б)SiC,B,Si
в)O2,N2,He