у г 25 г
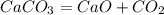
100 г 56 г
1. Сначала найдем теоретически возможный выход извести:
20 г извести - это только 80% от теоретически возможного, а
х г__________________100 г, откуда х=20*100/80=25 г
2. Подставив эту массу в уравнение реакции,найдем истинную массу карбоната,который прокалили:
при прокаливании 100 г карбоната образуется 56 г извести, а
при --//--//-- у г___________________25 г, откуда у=100*25/56=приблизительно 45 г
IIA - группа щелечноземелных металлов (бериллий - Be, магний - Mg, кальций - Ca, стронций - Sr, барий - Ba, радий - Ra)
Na2CO3·10H2O — натрит, или сода (именно от слова сода произошло англоязычное название натрия - Sodium),
KCl - сильвин
KCl·NaCl - сильвинит (соединение двух твердых растворов в соотношении молей 1:1)
K2CO3 - поташ (от Potassium)
MgCl2 - основа бишофита
ВаСО3 - витерит
Гиалофан - (K,Ba)[Al(Si,Al)Si2O8]
Сванбергит - SrAl3(PO4)(SO4)(OH)6
Стронцианит - SrCO3
Астраханит - Na2Mg(SO4)2·4(H2O)
Я думаю достаточно.