х г 9,22 г
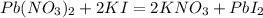
331 г 461 г
1. Сначала найдем массу нитрата свинца по массе осадка:
при взаимодействии 331г нитрата выпадает 461г осадка, а
при --//--//-- х г__________________9,22 г, откуда
х=331*9,22/461=6,62 г
2.Теперь отнеся эту массу к массе всего раствора,и получим массовую долю нитрата в растворе:
w(Pb(NO3)2)=m(Pb(NO3)2)/m(раствора)=6,62/220=0,03 или 3%
Видимо ты неправильно задачу написала, т.к там гидросульфата и сульфата НАТРИЯ
1) С NaOH будет реагировать только NaHSO3.
Составляем уравнение реакции: NaHSO4 + NaOH = Na2SO4 + H2O
2) m(NaOH раствор) = 144 * 1,11 = 159,84г
m(NaOH чистого) = 159,84 * 0,1 = 15,984г
Находим n(NaOH)=15,984 / 40 = 0,4 моль
Т.к. соотношение NaHSO и NaOH в уравнении 1к1, то n(NaHSO4)=0,4 моль
m(NaHSO4) = 0,4 * 120 = 48г
48г это 40% смеси, нам надо найти оставшиеся 60% Na2SO4. Для этого находим 100% : 48 * 100/40 = 120г - вся смесь, далее, 120 - 48 = 72г - это m(Na2SO4).
3) вторая реакция: Na2SO4 + Ba(OH)2 = 2NaOH + BaSO4
n(Na2SO4) = 72/142 = 0,51 моль, тогда m(BaSO4)=0,51 * 233= 118.83 г
ответ: 118.83 г
P.S. Исправлено.
ΔrG=ΔrH-TΔrS, для ΔG0 Т равно 298К
1) ΔН Fe2O3 К = -822,2 кДж/моль, Fe3O4 к = - 1117,1 H2Oг = -241.8
ΔrН = 2*(-1117.1) +(-241.8) - 3*(-822.2) = -476 + 2466.6 = 1790.6
ΔS Fe2O3 К = 60.75 Дж/моль*K, Fe3O4 к = 146.2 H2Oг = 188.74
ΔrS = 2*146.2 +188.74 - 3*60.75 = 481.14-182.25 = 298.89Дж= 0,29889 кДж
ΔrG = 1790.6 -298* 0,29889 = 1701,53
2)
ΔН Fe2O3 К = -822,2 кДж/моль, СО = -110,5 Fe3O4 к = - 1117,1 СО2г = -393,5
ΔrН = 2*(-1117,1) +(-393,5) - [3*(-822.2) +(-110.5)] = -2627.7 + 2577.1 = -50 кДж
ΔS Fe2O3 К = 60.75 Дж/моль*K, СО г = 197,5 Fe3O4 к = 146.2 СО2 г = 213,7
ΔrS = 2* 146,2 + 213,7 - (3*60,75 + 197,5) = 506,1 - 379,75 = 126,35Дж = 0,12635 кДж
ΔrG = -50 - 298*0,12635 = -87,65
3) ΔН Fe2O3 К = -822,2 кДж/моль, СО = -110,5 СО2г = -393,5
ΔrН = 3*(-393,5) - [ -822.2 + 3* (-110.5)] = -1180.5 +1153.7 = -26.8
ΔS Fe2O3 К = 60.75 Дж/моль*K, СО г = 197,5 СО2 г = 213,7
ΔrS = 3*213.7 -(60.75 +3*197.5) = 641.1 -653.25= 12.15Дж = 0,01215
ΔrG = -26,8 - 298 *0,01215 = -23,18