Дано:
m(р-ра NaOH) = 50 гр
ω(NaOH) = 10%
Найти:
m(C₁₇H₃₅-COONa) - ?
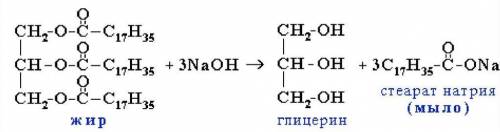
1) Для начала мы напишем уравнение реакций, то что известно по условию задачи, именно по такой уравнений реакций мы будем пользоваться. Уравнение этой реакций представлен внизу↓.
2) Далее находим массу чистого вещества у гидроксида натрия, а потом его количества вещества, и потом количества вещества у образовавшейся соли по уравнению реакций:
m(NaOH) = (m(р-ра NaOH)×ω(NaOH))/100% = (50 гр × 10%)/100% = 50 гр × 0,1 = 5 гр
M(NaOH) = 23 + 16 + 1 = 40 гр/моль
n(NaOH) = m(NaOH)/M(NaOH) = 5 гр / 40 гр/моль = 0,125 моль
n(NaOH) : n(C₁₇H₃₅-COONa) = 3 : 3 = 1 : 1 ⇒ n(C₁₇H₃₅-COONa) = n(NaOH) = 0,125 моль - по уравнению реакций
3) Теперь находим массу образовавшейся соли:
M(C₁₇H₃₅-COONa) = 12×18 + 1×35 + 16×2 + 23 = 216 + 35 + 32 + 23 = 306 гр/моль
m(C₁₇H₃₅-COONa) = n(C₁₇H₃₅-COONa)×M(C₁₇H₃₅-COONa) = 0,125 моль × 306 гр/моль = 38,25 гр
ответ: m(C₁₇H₃₅-COONa) = 38,25 гр
Решено от : 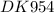
1.Где содержится больше молекул:
а) в 15г. муравьиного альдегида- НСНО или в 5.6 л. (н.у.)C₂H₆- этана ?
б) в 3.8 г.фтора F₂ или в 11.2 л. (н.у.) хлороводорода HCl?
в) в 4.4 г. пропана С₃Н₈ или в 0.1 моль СО₂?
2. Какой объем займут 1.67·10²³ CO₂
Решение: (знак÷ это деление)
а) M(HCHO) =1+16+1+16=34г.
m(HCHO)=15г.
n( HCHO)= m÷M=15÷34=0,44моль
Na(HCHO)=6·10²³ молекул
N(HCHO)=n x Na= 0,44×6·10²³= 2,64·10²³молекул
Vm( C₂H₆) =22,4л.
n(C₂H₆)= V÷Vm= 5,6÷22,4=0,25моль
Na(C₂H₆)=6·10²³молекул
N(C₂H₆)= n x Na=0,25×6·10²³=1.5·10²³ молекул
Вывод: в 15 г. HCHO больше молекул чем 5,6л.C₂H₆
б) M(F₂) =19г.
m(F₂) = 3.8г.
n(F₂)= m÷M= 3.8÷19= 0.2моль
Na(F₂) = 6·10²³молекул
N(F₂)= nxNa= 0,2×6·10²³= 1.2·10²³молекул
Vm=22,4л.
V(HCl)=11,2л.
n(HCl)= V÷Vm =11,2÷22,4=0,5моль Na(HCl)=6·10²³молекул
N(HCl)= n x Na= 0,5×6·10²³=3·10²³ молекул
Вывод: в 11,2л.HCl больше молекул чем в3,8г.F₂
в) M(C₃H₈) =12х3+1х8=44г.
m(C₃H₈)=4,4г.
n(C₃H₈)=m÷M=4,4÷44=0,1моль
Na(C₃H₈)=6·10²³молекул
N(C₃H₈)= n x Na =0,1×6·10²³= 0,6·10²³молекул
Vm(CO₂)=22,4л./моль n(CO₂)=0,1моль
Na(CO₂)= 6·10²³ молекул
N(CO₂)= n x Na= 0,1×6·10²³=0,6·10²³ молекул
Вывод: в 4,4г. C₃H₈ и в 0,1моль CO₂ одинаковое число молекул.
2. Какой объем займут 1.67·10²³ CO2
Vm (CO₂)= 22.4л.моль Na (CO₂)= 6·10²³ молекул
Задачу решаем используя формулы:
1. n= N÷Na n=1.67·10²³ ÷ 6·10²³=0,278моль
2. V=Vm×n= 22,4л.×0,278моль=6,23л.
ответ: 1.67·10²³ CO2 займет объем 6,23л.