
Основные законы химии
Стехиометрические законы химии
1) Закон сохранения массы веществ: (М.В.Ломоносов, 1748г): масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Pb+O2=PbO (в реторте)
2) Закон постоянства состава: (Пруст, 1808г) – всякое чистое вещество независимо от его получения всегда имеет постоянный качественный и количественный состав.
3) С значения относительной плотности были определены относительные молекулярные массы и уточнены составы молекул многих газообразных веществ. Молекулярная масса может быть вычислена также по уравнению состояния идеального газа или Уравнения Клапейрона-Менделеева.
clip_image002 или clip_image004 clip_image006
P -давление газа в замкнутой системе
V – объем системы (м3)
m – масса газа (кг)
М – молярная масса
Т – абсолютная t° в Кельвинах
R – универсальная газовая постоянная
P = 101,325 кПа
Используемые величины:
clip_image008
clip_image010
Основные газовые законы химии:
1) Бойля–Мариотта при постоянной t°, давление, производимое данной массой газа, обратно пропорционально объему газа
clip_image012 t° – const.
2) Гей-Люссака при постоянном давлении объем газа изменяется прямо пропорционально абсолютной температуре
clip_image014, при P – const.
3) Шарля: при постоянном объеме давление газа изменяется прямо пропорционально абсолютной температуре.
clip_image016, при V – const.
4) Объединенный закон Бойля-Мариотта, Гей-Люссака и Шарля:
clip_image018
Парциальным давлением газа в смеси называется давление, производил бы этот газ, занимая при тех же физических условиях объем все газовой смеси.
Общее давление газовой смеси равно Σ парциальных давлений.
3. Закон кратных отношений.
Если два элемента образуют друг с другом несколько соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся как небольшие целые числа.
FeO Fe2O3
w(Fe) = 78%
w(O) = 22%
Fe – x
O –y
x : y - ?
x : y
Fe : O = clip_image020
FeO – простейшая формула.
4) Закон эквивалентов: (открыт в конце XVIIIв.) – вещества взаимодействуют между собой в количествах, пропорциональных их химическим эквивалентам.
clip_image022
Эквивалент – химическим эквивалентом элемента называется такое его количество, которое соединяется с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях. Химический эквивалент не является постоянной величиной, он зависит от валентности элемента.
К середине XIX века в химии сложился свой язык, который был узаконен на первом международном съезде химиков в 1860 году в г.Карлсруэ (Германия). начальные буквы их латинских наименований O – oxygenium – кислород
Каждое соединение обозначается химической формулой, которая показывает качественный и количественный состав вещества.
Na2SO4 – 2 атома Na
clip_image0231 атом серы
индексы
4 атома кислорода
В практике используются 3 (три) вида формул.
1) Эмпирическая (простейшая)
H2O, NaOH, CH4, и т.д.
2) Молекулярная, которая уточняет эмпирическую и показывает сложные ионы, молекулы или фрагменты, входящие в формулу.
KAl(SO4)2 • 12H2O; (NH4)2S2O8; C6H6
3) Структурная или графическая
clip_image024clip_image025С6H6 C2H2 CHclip_image027CH
H2O2 H – O – O – H H2SO4
Любое химическое превращение одних соединений в другие называется химической реакцией:
коэффициенты
clip_image028C2H5OH + 3O2 → 3H2O+2CO2
4. Закон простых объемных отношений, или «химический» закон (Гей-Люссак, 1808) – объемы вступающих в реакцию газов при одинаковых условиях относятся друг к другу, а также к объемам образующихся газообразных продуктов как небольшие целые числа.
5. Закон Авогадро: (Авогадро, 1811г.) – в равных объемах различных газов при одинаковых условиях (t˚ и давлении) содержится одинаковое число молекул. Из закона вытекают 2 следствия:
1. 1 моль любого газа при одинаковых условиях занимает один и тот же объем – равный 22,4 л. (t˚-0˚C и давление 1,01325•105 Па). В этом же объеме находится 6,023•1023 молекул газообразного вещества.
2. Массы равных объемов двух газов, взятых при одинаковом давлении и to, относятся друг к другу как их молярные массы:
clip_image030, также плотности газов относятся как их относительные молекулярные массы: clip_image032, Д – относительная плотность.
6. Периодический закон и периодическая система химических элементов Д.И.Менделеева.
Для правильного написания химических формул надо знать валентность элементов или степень окисления. Валентностью называется атомов данного элемента присоединять или замещать определенное число других атомов.
max вал. = 8. clip_image034 clip_image036
 моль
моль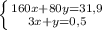
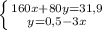

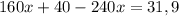

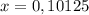 моль (это количество вещества Fe₂O₃)
моль (это количество вещества Fe₂O₃)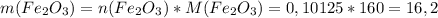 г
г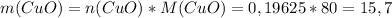 г
г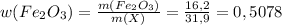 или 50,78% (где m(X) - это масса смеси)
или 50,78% (где m(X) - это масса смеси)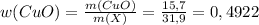 или 49,22%
или 49,22%