Реакция: 2AgNO3 + Zn = 2Ag + Zn(NO3)2
Увеличение массы пластины на 2 г (20 -18=2) обусловлено как переходом части цинка в раствор, так и выделением на ней серебра. Если примем за Х количество растворившегося цинка, можно составить уравнение:
2X*108 - X*65 = 2, или 151Х = 2, откуда Х=0,0132 моль.
Количество нитрата серебра в исходном растворе - вдвое больше, т. е. 0,0264 моль. Масса нитрата серебра:
m(AgNO3) = n*M = 0,0264 моль*170 г/моль = 4,5 г
Массовая доля нитрата серебра в растворе:
w(AgNO3) = m(AgNO3)/m(р-ра) = 4,5 г/150 г = 0,03, или 3%
Zn + 2HCl = ZnCl₂ + H₂
mр-ра(HCl) = 500г
ω(HCl) = 20% = 0.2
mв-ва(HCl) = mр-ра × ω = 500г × 0.2 = 100г
n(HCl) =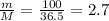 моль
моль
n(HCl) = n(H₂) = 2.7 моль ÷ 2 = 1.35 моль
m(H₂) = n × M = 1.35 моль × 2г\моль = 2.7г
V(H₂) = n × Vm = 1.35 моль × 22.4 л\моль = 30.24 л