Итак, . я знаю, для кого-то просто, но я её не понимаю. : 1)составить и решить две цепочки уравнений, используя соединения азота (азот, аммиак, соли аммония, оксиды азота, азотная кислота, нитраты) 2) напишите уравнения реакций. 1) карбонат аммония - аммиак - азот - нитрид лития - аммиак - ацетат
аммония 3) решить . промышленность выпускает три сорта разбавленной азотной кислоты: 55%, 47% и 45%. вычислите массу каждого из растворов, который потребуется для получения нитрата аммония массой 800 кг. 4) решить . вычислите объем аммиака (н. который можно получить при взаимодействии хлорида
аммония массой 10,7г и гидроксида кальция массой 37г.
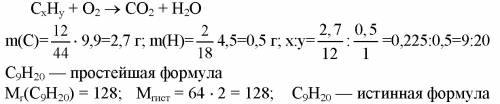
составим уравнение горения углеваодорода
3.2г 9,9 г 4,5 г
СхHy + O2 = CO2 + H2O
1. находим относительную молекулярную углеводорода (умножаем относительную плотность на относительную молекулярную массу водорода)
M(СхНy)=D*M(H2) = 64*2=128
найдем массы элементов
m(С) = 9.9*12/44 = 2.7г
m(H)=4.5*2/18 = 0.5г
найдем массовые доли элементов в углеводороде
w(C)=0.27/3.2 = 0.84375
w(H) = 0.5 / 3.2 = 0.15625
Найдем число атомов
N=w*M/Ar
N(C) = 0.84375*128/12 = 9
N(H) = 0.15625 * 128 / 1 = 20
C9H20