1. Если 1000 мл воды содержит 200 мг гидрокарбоната, то
250 мл________________х мг, откуда х=250*200/1000=50 мг или 0,05 г
0,05 г х г
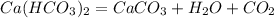
162 г 100 г
При разложении 162 г гидрокарбоната выпадает 100 г карбоната, а
при -- // -- 0,05 г_______________________у г, откуда
у=0,05*100/162=0,03 г или 30 мг
2. Примем массу гидроксида за Х, подставим в формулу по определению массовой доли растворенного вещества и получим уравнение:
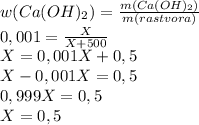 г
г
Теперь,подставив в уравнение массу гидроксида,определим массу оксида:
у г 0,5 г
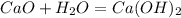
56 г 74 г
при взаимодействии 56 г оксида образуется 74 г гидроксида, а
при -- // -- у г_________________0,5 г, откуда
у=56*0,5/74=0,38 г
1. Если 1000 мл воды содержит 200 мг гидрокарбоната, то
250 мл________________х мг, откуда х=250*200/1000=50 мг или 0,05 г
0,05 г х г
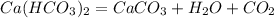
162 г 100 г
При разложении 162 г гидрокарбоната выпадает 100 г карбоната, а
при -- // -- 0,05 г_______________________у г, откуда
у=0,05*100/162=0,03 г или 30 мг
2. Примем массу гидроксида за Х, подставим в формулу по определению массовой доли растворенного вещества и получим уравнение:
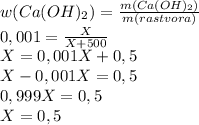 г
г
Теперь,подставив в уравнение массу гидроксида,определим массу оксида:
у г 0,5 г
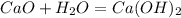
56 г 74 г
при взаимодействии 56 г оксида образуется 74 г гидроксида, а
при -- // -- у г_________________0,5 г, откуда
у=56*0,5/74=0,38 г
В зависимости от количества веществ получится либо средняя, либо кислая соль, поэтому найдем количества веществ
М(NH3)=17г/моль
М(H2SO4)=98г/моль
n(NH3)=51/17=3 моль - избыток, значит соль будет средняя
n(H2SO4)=196/98= 2 моль
2NH3+H2SO4=(NH4)2SO4 - сульфат аммония
Задача решается по недостатку
Т. К. из 1 моль кислоты по уравнению образуется 1 моль соли, то соли для данного случая будет 2 моль
М((NH4)2SO4)=132 г/моль
m((NH4)2SO4)=132*2=264 г