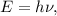
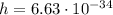 Дж·с - это постоянная планка, а
Дж·с - это постоянная планка, а  - это частота. Таким образом, при заданной в условии частоте фотон обладает энергией:
- это частота. Таким образом, при заданной в условии частоте фотон обладает энергией: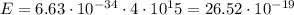 Дж. Энергию можно выразить в электрон-вольтах: 1 эВ =
Дж. Энергию можно выразить в электрон-вольтах: 1 эВ = 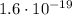 Дж. По физическому смыслу 1 эВ - это энергия, необходимая, чтобы перенести элементарный заряд (электрон) под действием разности потенциалов в 1 В. Таким образом, можем выразить полученную энергию в электронвольтах:
Дж. По физическому смыслу 1 эВ - это энергия, необходимая, чтобы перенести элементарный заряд (электрон) под действием разности потенциалов в 1 В. Таким образом, можем выразить полученную энергию в электронвольтах: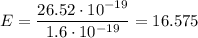 эВ.
эВ.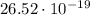 Дж или 16.575 эВ.
Дж или 16.575 эВ.
Этот окислительно-восстановительный процесс протекает на электродах при прохождении постоянного электрического тока через растворы или расплавы электролитов.
На отрицательно заряженном электроде - катоде происходит электрохимическое восстановление частиц (атомов, молекул, катионов) , а на положительно заряженном электроде - аноде идет электрохимическое окисление частиц (атомов, молекул, анионов) .
Примеры электролиза расплавов:
Электролиз воды проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита - воды) :
В зависимости от инертного электролита электролиз проводится в нейтральной, кислотной или щелочной среде. При выборе инертного электролита необходимо учесть, что никогда не восстанавливаются на катоде в водном растворе катионы металлов, являющихся типичными восстановителями (например Li+, Cs+, K+, Ca2+, Na+, Mg2+, Al3+) и никогда не окисляется на аноде кислород O−II анионов оксокислот с элементом в высшей степени окисления (например ClO4−, SO42−, NO3−, PO43−, CO32−, SiO44−, MnO4−), вместо них окисляется вода
.
Примеры электролиза растворов солей:
(на аноде окисляются анионы Сl−, а не кислород O−II молекул воды, так как электроотрицательность хлора меньше, чем кислорода, и следовательно, хлор отдает электроны легче, чем кислород)
(на катоде восстанавливаются катионы Cu2+, а не водород HI молекул воды, так как медь стоит правее водорода в ряду напряжений, то есть легче принимает электроны, чем HI в воде) .
Таким образом, электролиз - это окислительно-восстановительная реакция, которая протекает под действием и при участии электрического тока. Уравнения электрохимических реакций отражают те процессы, которые без электрического тока протекать не могут.