Высота слоя керосина 16,5 см.
Объяснение:
h₁ = 20 см = 0,2 м - высота слоя воды
ρ₁ = 1000 кг/м³ - плотность воды
h₂ = 5 мм = 0,005 м - высота слоя ртути
ρ₂ = 13600 кг/м³ - плотность ртути
ρ₃ = 800 кг/м³ - плотность керосина
h₃ - высота слоя керосина
Давление воды в одном колене на нижнем уровне столбика воды
р = ρ₁ · g · h₁
Давление ртути и керосина в другом колене на нижнем уровне столбика воды
p = ρ₂ · g · h₂ + ρ₃ · g · h₃
Приравняем правые части выражений
ρ₁ · g · h₁ = ρ₂ · g · h₂ + ρ₃ · g · h₃
или
ρ₁ · h₁ = ρ₂ · h₂ + ρ₃ · h₃
откуда высота столбика керосина
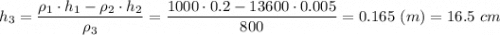
Высота равняется 20 метрам.
Объяснение:
Напряжение на зажимах равна 12 В. С какой высоты должен упасть груз массой 12 кг, чтобы сила тяжести выполнила такое же самую работу, которую выполняет электрическое поле при перемещении 200 Кл.
Дано:
U = 12 B
m = 12 кг
q = 200 Кл
h - ?
1)
Работа электрического поля по перемещению заряда:
Aэ = q·U (1)
2)
Потенциальная энергия тела:
Aп = m·g·h (2)
3)
Приравняем (2) и (1):
m·g·h = q·U
Тогда высота, с которой упало тело:
h = q·U / (m·g)
h = 200·12 / (12·10) = 20 м
Первый закон (первое начало) термодинамики - это, фактически, закон сохранения энергии. Он утверждает, что
энергия изолированной системы постоянна. В неизолированной системе энергия может изменяться за счет: а) совершения работы над окружающей средой; б) теплообмена с окружающей средой.
Для описания этих изменений вводят функцию состояния - внутреннюю энергию U и две функции перехода - теплоту Q и работу A. Математическая формулировка первого закона:
dU = Q - A (дифференциальная форма) (2.1)
U = Q - A (интегральная форма) (2.2)
Буква в уравнении (2.1) отражает тот факт, что Q и A - функции перехода и их бесконечно малое изменение не является полным дифференциалом.
В уравнениях (2.1) и (2.2) знаки теплоты и работы выбраны следующим образом. Теплота считается положительной, если она передается системе. Напротив, работа считается положительной, если она совершается системой над окружающей средой.
Существуют разные виды работы: механическая, электрическая, магнитная, поверхностная и др. Бесконечно малую работу любого вида можно представить как произведение обобщенной силы на приращение обобщенной координаты, например:
Aмех = p. dV; Aэл = . dе; Aпов = . dW (2.3)
( - электрический потенциал, e - заряд, - поверхностное натяжение, W - площадь поверхности). С учетом (2.3), дифференциальное выражение первого закона можно представить в виде:
dU = Q - p. dV Aнемех (2.4)
В дальнейшем изложении немеханическими видами работы мы будем, по умолчанию, пренебрегать.
Механическую работу, производимую при расширении против внешнего давления pex, рассчитывают по формуле:
A = (2.5)
Если процесс расширения обратим, то внешнее давление отличается от давления системы (например, газа) на бесконечно малую величину: pex = pin - dp и в формулу (2.5) можно подставлять давление самой системы, которое определяется по уравнению состояния.
Проще всего рассчитывать работу, совершаемую идеальным газом, для которого известно уравнение состояния p = nRT / V (табл. 1).
Таблица 1. Работа идеального газа в некоторых процессах расширения V1 V2:
Процесс
A
Расширение в вакуум
0
Расширение против постоянного внешнего давления p
p (V2-V1)
Изотермическое обратимое расширение
nRT ln(V2/V1)
Адиабатическое обратимое расширение
nCV(T1-T2)
При обратимом процессе совершаемая работа максимальна.
Теплота может переходить в систему при нагревании. Для расчета теплоты используют понятие теплоемкости, которая определяется следующим образом:
C = (2.6)
Если нагревание происходит при постоянном объеме или давлении, то теплоемкость обозначают соответствующим нижним индексом:
CV = ; Cp = . (2.7)
Из определения (2.6) следует, что конечную теплоту, полученную системой при нагревании, можно рассчитать как интеграл:
Q = (2.8)
Теплоемкость - экспериментально измеряемая экстенсивная величина. В термодинамических таблицах приведены значения теплоемкости при 298 К и коэффициенты, описывающие ее зависимость от температуры. Для некоторых веществ теплоемкость можно также оценить теоретически методами статистической термодинамики (гл. 12). Так, при комнатной температуре для одноатомных идеальных газов мольная теплоемкость CV = 3/2 R, для двухатомных газов CV = 5/2 R.
Теплоемкость определяется через теплоту, переданную системе, однако ее можно связать и с изменением внутренней энергии. Так, при постоянном объеме механическая работа не совершается и теплота равна изменению внутренней энергии: QV = dU, поэтому
CV = . (2.9)
При постоянном давлении теплота равна изменению другой функции состояния, которую называют энтальпией:
Qp = dU + pdV = d (U+pV) = dH, (2.10)
где H = U+pV - энтальпия системы. Из (2.10) следует, что теплоемкость Cp определяет зависимость энтальпии от температуры.
Cp = . (2.11)
Из соотношения между внутренней энергией и энтальпией следует, что для моля идеального газа
Cp - CV = R. (2.12)
Внутреннюю энергию можно рассматривать, как функцию температуры и объема:
(2.13)
Для идеального газа экспериментально обнаружено, что внутренняя энергия не зависит от объема, , откуда можно получить калорическое уравнение состояния:
dU = CV dT,
(2.14)
В изотермических процессах с участием идеального газа внутренняя энергия не изменяется, и работа расширения происходит только за счет поглощаемой теплоты.
Возможен и совсем иной процесс. Если в течение процесса отсутствует теплообмен с окружающей средой ( Q = 0), то такой процесс называют адиабатическим. В адиабатическом процессе работа может совершаться только за счет убыли внутренней энергии. Работа обратимого адиабатического расширения идеального газа: