
ответ:Уравнение состояния идеального газа (уравнение Менделеева — Клапейрона) - устанавливает зависимость между давлением, объёмом и абсолютной температурой идеального газа. Уравнение имеет вид: pV=mMRT, где p – давление (Па), V – объем газа (м3), m – масса газа (кг), M – молярная масса, R=8.31 Дж/моль*K? универсальная газовая постоянная, T – абсолютная температура газа. Определите температуру (К) кислорода массой 64 г, находящегося в сосуде объёмом 1 л при давлении 5 • 10^6 Па. Молярная масса кислорода М = 0,032 кг/моль. ответ округлите до целого числа.
Подставим все известные в уравнение и найдем температуру.
T=pV∗Mm∗R=5∗106∗1∗10−3∗0.03264∗10−3∗8.31=301.
Объяснение:
Дано:
F = 80 Дж
S = 20 см²
L = 40 см = 0,4 м
Знайти:
P - ?
Розв'язання:
A = F · L = P · S · L
P = A / S · L =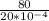 · 0,4 =
· 0,4 = 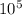 (Па)
(Па)