Интересная задача
Дано:
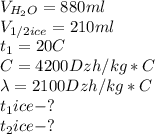
Для начала вспомним закон сохранения мас. Масса неизменная при переходе телом из одного агрегатного состояния в другое.
Поэтому мы может высчитать масу снега в термосе.
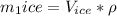
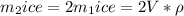
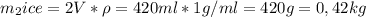
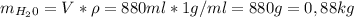
Мы нашли масу снега, поэтому подставим в уравнение теплового баланса
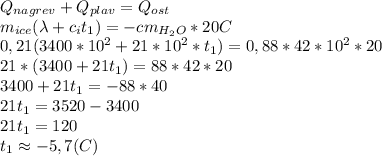
Минус появился, поскольку мы решали только арифметику, и не учитывали, кто теплоту отдает.
Второй вопрос можно решить логически. По сути у нас удельная теплоемкость льда в два раза меньше, а массу при этом мы берем вдвое больше, поэтому можно будет поделить обе части на эту теплоемкость и получится:
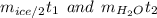
Очевидно, что масса снега меньше, чем воды (примерно в 4 раза), если подставить температуру 20 в правую часть, то при сравнении будет знак <, то бишь у воды еще останется запас теплоты.
Но на плавление льда её не хватит, поскольку лямбда намного больше чем. 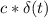
Основной характеристикой атомов и молекул служит относительная атомная масса элемента (сокращенно – атомная масса) и относительная молекулярная масса вещества (сокращенно – молекулярная масса). За единицу атомной массы выбрана часть массы атома углерода.
Атомной массой Аr химического элемента называется отношение массы атома этого элемента к массы атома углерода.
Молекулярной массой Mr вещества называется отношение массы молекулы этого вещества к массы атома углерода. Ясно, что атомная и молекулярная масса – величины безразмерные.
Как только что было определено, единица массы, равная массы атома углерода, называется атомной единицей массы. Обозначим эту единицу, выраженную в килограммах, через mед. Тогда масса атома, выраженная в килограммах, будет равна Аrmед, а масса молекулы – Mrmед.
Количество вещества, в котором содержится число молекул, равное числу атомов в 0,012 кг углерода С, называется молем.
Число молекул, содержащихся в одном моле, называется числом Авогадро. Экспериментально определено, что число Авогадро