молекулы воздуха движутся и потому непрерывно ударяют о стенки шарика внутри и снаружи. При откачивании воздуха число молекул под колоколом вокруг оболочки шарика уменьшается. Но внутри завязанного шарика их число не изменяется. Поэтому число ударов молекул о внешнюю поверхность оболочки становится меньше числа ударов о внутреннюю поверхность. Из-за этого шарик раздувается и принимает такие размеры, при которых сила упругости его резиновой оболочки становится равной силе давления газа, находящегося внутри его.
Сферическая форма, которую принимает раздутая оболочка шарика показывает, что газ оказывает по всем направлениям одинаковое давление.
Выясним, как зависит давление газа от его объема. Температуру газа будем считать постоянной.
Если объем газа уменьшить, но так, чтобы масса его осталась неизменной, то в каждом кубическом сантиметре газа молекул станет больше. Это означает, что плотность газа увеличится. Тогда число ударов молекул о стенки сосуда возрастет и давление газа станет больше.
итог, давление воздуха, зависит не только от массы.
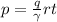
где, p давление
q давление
гамма - количество
r- газ.постоянная
t - температура
допустим, t постоянно, как и собственно r.
тогда, давление прямо пропорционально давлению и обратно пропорционально количеству вещества.
а здесь думаю станет всё ясно.
PS: за формулы сорри, приложение не позволяет пользоваться греческими символами, и заглавными тоже. вопрос, задачи по математике и физике без этого ? интересно, разрабы об этом не подумали?!
ответ:Уравнение состояния идеального газа (уравнение Менделеева — Клапейрона) - устанавливает зависимость между давлением, объёмом и абсолютной температурой идеального газа. Уравнение имеет вид: pV=mMRT, где p – давление (Па), V – объем газа (м3), m – масса газа (кг), M – молярная масса, R=8.31 Дж/моль*K? универсальная газовая постоянная, T – абсолютная температура газа. Определите температуру (К) кислорода массой 64 г, находящегося в сосуде объёмом 1 л при давлении 5 • 10^6 Па. Молярная масса кислорода М = 0,032 кг/моль. ответ округлите до целого числа.
Подставим все известные в уравнение и найдем температуру.
T=pV∗Mm∗R=5∗106∗1∗10−3∗0.03264∗10−3∗8.31=301.
Объяснение:
50 км/ч 250 км
Объяснение:
v1=40 км/ч v2=60 км/ч t=5 ч vcp=? s=?
===
vcp=(s1+s2)/(t1+t2)
t1=t2=t/2=5/2=2.5 ч
s1=v1*t1
s2=v2*t2
vcp=(t/2)*(v1+v2)/t=(v1+v)/2=(40+60)/2=50 км/ч
s=s1+s2=(t/2)*(v1+v2)=(5/2)*(40+60)=250 км